题目内容
【题目】天然气是一种比较清洁的化石能源,主要成分为甲烷。现对甲烷的制取、性质、应用做以下研究,请回答相关问题。(制取研究)
查阅资料得知:①通常情况下,甲烷是一种无色无味难溶于水的气体,密度比空气小;
②实验室常用无水醋酸钠(CH3COONa)和碱石灰(发生反应的是其中的氢氧化钠)两种固体药品,研磨均匀混合,通过加热制取甲烷,同时还生成碳酸钠。
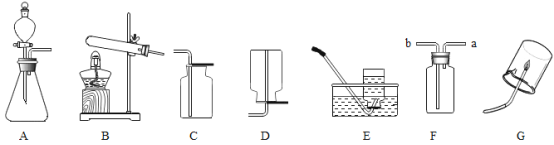
在实验室中:(1)可用于制取甲烷的发生装置为_____(填字母)。
(2)可用于收集甲烷的装置为_____(填字母)。
(3)制取甲烷的化学方程式:_____。
(4)可用水将F中气体压出,通入G中,那么,水应从端_____(填“a”或“b”)注人。
(5)点燃后,烧杯内壁看到的现象是_____,同时还生成二氧化碳气体,请设计一个简单实验证明:_____。
(6)(应用研究)尿素[CO(NH2)2]是一种常用氮肥。下图是利用甲烷制尿素的主要流程:
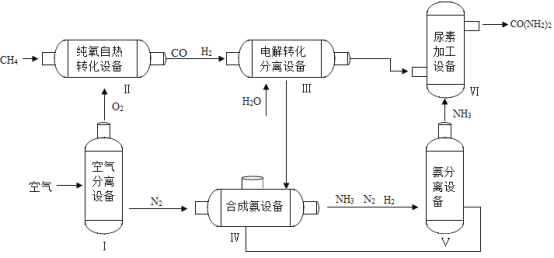
设备I中分离氮气和氧气的过程发生了_____(填“物理变化”或“化学变化”)。
(7)设备Ⅲ中产生并分离开CO2和H2,进入下一设备使用,依据流程图可判断进入设备VI的是_____。
(8)设备V中的气体,可以循环利用的是_____。
【答案】B D或E ![]() b 烧杯内壁有水雾出现 将烧杯倒过来,滴入几滴澄清石灰水,振荡,石灰水变浑浊,说明生成二氧化碳 物理变化 CO2 H2和N2
b 烧杯内壁有水雾出现 将烧杯倒过来,滴入几滴澄清石灰水,振荡,石灰水变浑浊,说明生成二氧化碳 物理变化 CO2 H2和N2
【解析】
(1)无水醋酸钠和碱石灰中的氢氧化钠两种固体药品通过加热制取甲烷是固体受热反应生成气体,应选择固体受热发生装置,即装置B,故填B。
(2)甲烷是一种难溶于水的气体,所以收集甲烷可选择排水法,即装置E,且甲烷的密度比空气小,所以收集甲烷还可以选择向下排空气法,即装置D,故填D或E。
(3)无水醋酸钠和氢氧化钠在加热的条件下反应生成甲烷和碳酸钠,故反应的化学方程式写为:CH3COONa+NaOH![]() CH4↑+Na2CO3。
CH4↑+Na2CO3。
(4)气体的密度小于水的密度,用水将F中气体压出,则密度大的水应从长管,即b管注入,才能使密度小的气体沿短管导出,故填b。
(5)甲烷燃烧后生成水和二氧化碳,同时放出热量,生成的水获得热量转化为水蒸气,水蒸气遇到干冷烧杯在烧杯内壁冷凝成水雾,所以观察到的现象是烧杯内壁有水雾出现,故填烧杯内壁有水雾出现;
二氧化碳能与澄清石灰水中的氢氧化钙反应生成碳酸钙沉淀使澄清石灰水变浑浊,所以证明甲烷燃烧后生成二氧化碳的方法是将烧杯倒过来,滴入几滴澄清石灰水,振荡,石灰水变浑浊,说明生成二氧化碳,故填将烧杯倒过来,滴入几滴澄清石灰水,振荡,石灰水变浑浊,说明生成二氧化碳。
(6)设备I将空气中的氮气与氧气进行了分离,是混合物的分离过程,没有生成新物质,属于物理变化,故填物理变化。
(7)设备VI中生成的尿素由碳、氮、氧、氢四种元素组成,设备V中进入设备VI的物质是氨气,氨气中仅含有氮元素与氢元素,则设备III进入设备VI中的物质中应该含有碳元素与氧元素,所以该物质为设备Ⅲ中产生并分离出的CO2,故填CO2。
(8)设备V将NH3、N2、H2进行了分离,其中的NH3进入设备VI生成尿素,则N2、H2进入设备IV重新生成NH3,即其中可以循环利用的是H2和N2,故填H2和N2。