题目内容
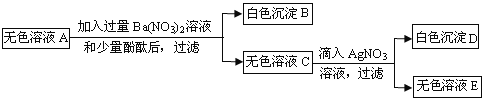
【题目】某校化学兴趣小组用一瓶含有少量氯化钠的硫酸钠固体样品,进行如图所示的实验。
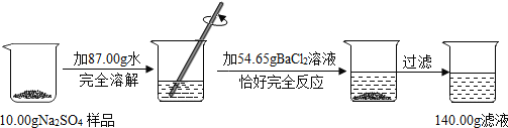
请根据以上信息计算(结果保留到小数点后两位):
(1)反应生成沉淀的质量为_____g。
(2)样品中硫酸钠的质量为_____g。
(3)求滤液中氯化钠的质量分数_____。
【答案】11.65 7.1 6.25%
【解析】
(1)根据质量守恒定律,反应生成沉淀的质量为10.00g+87.00g+54.65g-140.00g=11.65g;
(2)设样品中硫酸钠的质量为x,反应中生成的氯化钠质量为y。
![]()
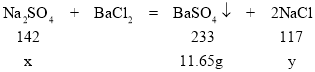
![]()
x=7.1g,y=5.85g
(3)滤液中氯化钠的质量=10.00g-7.1g+5.85g=8.75g
滤液中氯化钠的质量分数为:![]() ×100%=6.25%。
×100%=6.25%。
答:(1)反应生成沉淀的质量为11.65g;
(2)样品中硫酸钠的质量为7.1g;
(3)滤液中氯化钠的质量分数为6.25%。

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案【题目】“504双吸剂”的成分如标签所示,甲、乙两位同学对一包久置的“504双吸剂”探究,他们猜想久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2、CaCO3。

已知:铁与氧化铁溶液反应的化学方程式为:Fe+2FeCl3═3FeCl2。
请你补充甲同学设计并记录的部分实验报告:
实验操作 | 实验现象 | 实验结论 |
1.取少量固体于试管中,_______,将生成气体通入澄清石灰水中。 | 产生大量气泡,得到浅绿色溶液,澄清石灰水变浑浊。 | 固体中一定含有_____,不一定含Fe2O3 |
2.取少量固体于试管中,加水溶解,静置后取上层清液滴加无色酚酞试液。 | 试管底部有不溶物,试管外发热,____ | 固体中含有CaO和Ca(OH)2 |
写出实验操作1中产生大量气泡的反应的化学方程式__________________。
(若正确回答下列问题加4分,总分不超过40分)
实验质疑:乙同学认为“固体中含有CaO和Ca(OH)2”的实验结论不正确,请阐述理由___________。
请你设计实验探究固体中是否含有Fe2O3______________(写出实验步骤即可)。
【题目】在密闭容器内有氧气、二氧化碳、水蒸气和一种未知物质W,在一定条件下充分反应,测得反应前后各物质的质量如表所示,则下列说法中正确的是( )
物质 | 氧气 | 二氧化碳 | 水蒸气 | W |
反应前质量/g | 50 | 1 | 1 | 23 |
反应后质量/g | 2 | 45 | 28 | x |
A. 根据质量守恒定律,x的值应为2
B. 该反应属于置换反应
C. 该反应中的二氧化碳和水蒸气的质量比为44:27
D. 该反应中物质W含碳元素的质量为10g