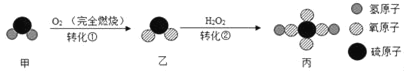
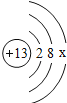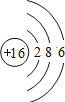题目内容
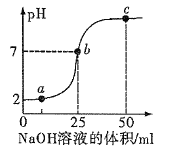
【题目】工业上以半水煤气(主要成分是 N2、H2、CO、CO2和H2O)、食盐等为原料制取纯 碱的流程如图 1:
(1)反应Ⅰ是在使用铜催化剂和加热条件下,半水煤气主要成分间发生反应,实现了 CO 转化,化学方程式是_____。
(2)将反应Ⅱ生成的 NH3和操作Ⅰ分离出的CO2通入饱和食盐水中即可得 NaHCO3固体,下列两种操作,你觉得更为合理的是_____。
a先通 NH3再通入CO2 b先通 CO2再通入 NH3
(3)操作Ⅱ的名称是_____,实验室进行该项操作时,需要用到的玻璃仪器有:普通漏斗、烧杯和_____,该仪器在此操作中的作用是_____。
(4)反应Ⅲ的成功实现说明该实验条件下,NaHCO3的溶解度_____(填“>”“<”或“=”)NH4Cl 的溶解度。
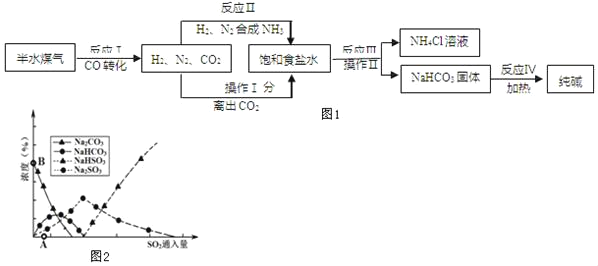
(5)纯碱用途广泛。工业上可用废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2,制备无水Na2SO3,达到减少污染、节约资源的目的。反应过 程中溶液组成变化如图 2 所示。
①吸收初期(图2中A点以前)反应的化学方程式为_____。
②不断通入 SO2,最终产物是_____。
【答案】CO+H2O![]() CO2+H2 a 过滤 玻璃棒 引流 < 2Na2CO3+SO2+H2O=2NaHCO3+Na2SO3 NaHSO3
CO2+H2 a 过滤 玻璃棒 引流 < 2Na2CO3+SO2+H2O=2NaHCO3+Na2SO3 NaHSO3
【解析】
根据给出的转化关系对应的过程分析每个对应的问题,或者直接分析每个问题,从给出的信息中找对应的信息。
(1)反应Ⅰ是在使用铜催化剂和加热条件下,半水煤气主要成分间发生反应,实现了 CO 转化,是一氧化碳转化为二氧化碳,根据反应前后变化可知,一氧化碳夺取水中的氧元素,对应的化学方程式是CO+H2O![]() CO2+H2;故填:CO+H2O
CO2+H2;故填:CO+H2O![]() CO2+H2
CO2+H2
(2)将反应Ⅱ生成的 NH3和操作Ⅰ分离出的CO2通入饱和食盐水中即可得 NaHCO3固体,由于最终是二氧化碳过量,所以为最大限量吸收二氧化碳,溶液最好为碱性,先通 NH3再通入CO2 ,合理的是a;故填:a
(3)操作Ⅱ实现固体和液体分离,为过滤,实验室进行该项操作时,需要用到的玻璃仪器有:普通漏斗、烧杯和 玻璃棒,该仪器在此操作中的玻璃棒的作用是引流;故填:玻璃棒;引流
(4)反应Ⅲ得到碳酸氢钠固体和氯化铵溶液,说明该实验条件下,NaHCO3的溶解度<NH4Cl 的溶解度。故填:<
(5)①根据图可知,开始是碳酸钠的浓度降低,而碳酸氢钠和亚硫酸钠的浓度升高,所以碳酸氢钠和亚硫酸钠是生成物,碳酸钠和二氧化硫是反应物,由于生成物含有氢元素,结合质量守恒定律可得,水也是反应物,所以吸收初期是碳酸钠、二氧化硫和水反应生成碳酸氢钠和亚硫酸钠,反应的化学方程式为2Na2CO3+SO2+H2O=2NaHCO3+Na2SO3,故填:2Na2CO3+SO2+H2O=2NaHCO3+Na2SO3
②不断通入SO2,根据图可知最终产物是亚硫酸氢钠。故填:NaHSO3

 综合自测系列答案
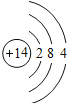
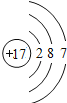
综合自测系列答案【题目】如图是第三周期部分元素的原子结构示意图,请根据题目要求填写下列空白.
第三周期 | Na | Al | Si | S | Cl |
(1)铝原子的质子数为_____,最外层电子数为_____,在化学反应中易失电子.
(2)当图中X=0时,则该粒子结构示意图表示的是_____;(填粒子符号)
(3)由第三周期元素组成AB4型化合物,其化学式可能是_____.
(4)图中同一周期元素原子的一条变化规律是_____.
【题目】食盐是人类生存的必需品,获取食盐的途径有多种。
(1)开采岩盐。地下盐层含氯化钠、硫酸钠等物质,构成硫酸钠的阴离子是_____ (填符号)。 除去氯化钠溶液中的硫酸钠应选用的试剂是_____(填化学式)溶液。
(2)熬制井盐。用井中产生的天然气作为燃料熬制井盐。CH4燃烧的化学方程式是_____。
(3)海水晒盐。某地海水中主要物质的含量见表。 该海水中氯化钠的质量分数为_____,配制某氯化钠溶液需 85mL 水,应选用量筒的规格为_____mL。
物质 | 每 100g 海水所含质量(g) |
水 | 96.5 |
氯化钠 | 2.7 |
硫酸钠 | 0.2 |
…… | …… |
(4)松花蛋的制作过程也需用氯化钠,还有生石灰、纯碱等,制作料泥时将上述原料加入水中,混合均匀即可。
从物质分类的角度看,该料泥是_____物,料泥中的“纯碱”是_____(填物质的名称) 的俗称;原料中可以做干燥剂的物质是_____(填化学式),它与水发生反应的化学方程式为_____,该反应过程_____热量(填“放出”或“吸收”)。