题目内容
某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如下图所示),大大提高了资源利用率,减少了环境污染。请填写:
(1)氯碱厂用电解饱和食盐水的方法制取烧碱,同时得到氯气和氢气。写出其化学方程式: 。
(2)钛冶炼厂氯化车间的氯化过程发生如下反应: 2FeTiO3+6C+7Cl2=2X+2TiCl4+6CO,则X的化学式为 。
(3)试写出TiCl4与Mg反应生成金属Ti的化学方程式 ,该反应属于 (填“化合”或“分解”或“置换”或“复分解”) 反应。上述反应需在氩气环境中进行,理由是 。上述反应制得的金属钛往往会混有另外一种金属单质杂质,该杂质为:______________;可以用何种试剂除去______________(填试剂名称)。
(4)同温同压下,任何气体之间的体积比就是它们的分子数之比。在一定条件下用H2和CO化合生成甲醇(化学方程式是2H2 + CO ="==" CH3OH),则合成甲醇时,H2和CO两种气体的体积比应为 。
(1)2NaCl+2H2O==2NaOH+H2↑+Cl2↑ (2)FeCl3 (3)TiCl4 + 2Mg="=" Ti + 2MgCl2 置换 氩气做保护气 Mg 稀盐酸(4)2∶1
解析

 阅读快车系列答案
阅读快车系列答案为了区别氢氧化钠和氢氧化钙溶液,甲同学设计了如下图所示的四组实验方案。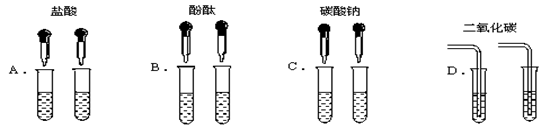
(1)其中能达到实验目的的是
(2)实验结束,甲同学将A、C组四支试管中的溶液倒入同一容器中,看到溶液变浑浊,该现象说明有 物质生成(填化学式),滴入酚酞后溶液呈红色。
(3)滴入酚酞后溶液呈红色,说明溶液呈碱性。使溶液呈碱性的物质是什么呢?甲同学进一步推测:溶液中呈碱性的物质可能是碳酸钠、氢氧化钙和 三种物质中的一种,或是三种物质两两混合组成的混合物。
(4)为了验证推测,甲同学查阅资料,获悉氯化钡溶液呈中性,并设计如下实验加以验证。请根据要求完成下列空白:
| 实验内容 | 预测现象 | 结论 |
| 取少量容器中的上层溶液于试管中,加入过量的氯化钡溶液,静置 | ①若有白色沉淀,溶液呈无色 | 物质是碳酸钠 |
| ②若无沉淀生成,溶液呈红色 | 物质是氢氧化钙 | |
| ③若有白色沉淀,溶液呈红色 | |
(6)若将一定量的Ca(OH)2溶液和100gNa2CO3溶液混合,充分反应后过滤,可得到5g白色沉淀,求该Na2CO3溶液的溶质的质量分数。
如图是三种物质的溶解度曲线,下列说法正确的是( )
| A.丙物质的饱和溶液升温后,将变成不饱和溶液 |
| B.t1℃时甲物质和乙物质的溶解度相等 |
| C.t2℃时将70g甲物质加入100g水中,可得到170g溶液 |
| D.甲物质的溶质质量分数一定比乙物质的溶质质量分数大 |





