��Ŀ����
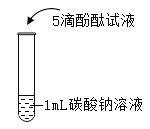
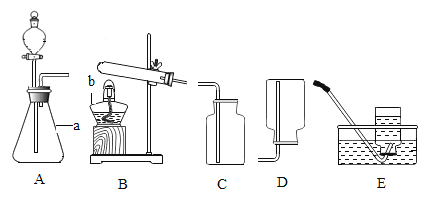
����Ŀ��ij��ȤС�������ͭ�����̼�۳�ַ�Ӧ��Ļ�������½���ʵ�飬�Բⶨ�������ͭ������������ʵ��װ������ͼ��ʾ������̨�ȹ̶�װ������ȥ��װ�����������ã���
���������ϣ���Ũ�����CO2��Ӧ��������ˮ�ԣ��������������
�ڼ�ʯ����Ҫ�ɷ�ΪCaO��NaOH��������H2O��CO2��
����ѡҩƷ��
ͭ�ۣ���̼����Ʒ���������̡���ʯ�ң�Ũ���ᡢ5������������Һ������ʯ��ˮ������������Һ��
����ʵ�鲽�����£�
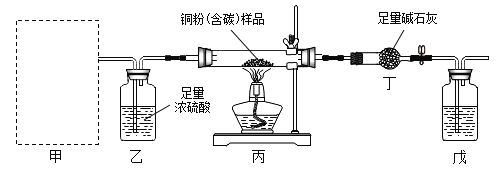
I����Ӳ�ʲ������м�������Ϊm��ͭ�ۣ���̼����Ʒ������װ��ҩƷ�������Ϊm1��
���Ƽ��е�װ�ã������������塣
��ȼ�ƾ��ƣ����������е�ҩƷ��ַ�Ӧ��Ϩ��ƾ��ơ�
��������ͨ�����壬ֱ����������ȴ��������������Ϊm2��
�Իش��������⣺
��1���״�������Ӧѡ������װ���е�_____����װ���з�����Ӧ�Ļ�ѧ����ʽΪ_____��
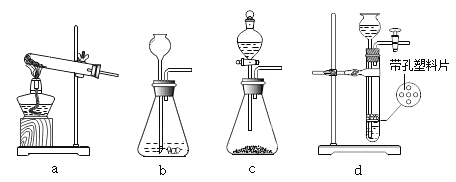
��2��װ���������Ϊ_____��
��3����Ʒ��ͭ�������ı���ʽΪ_____��
��4������װ���ң��ᵼ�²��ͭ����������_____������ƫС��������ƫ��"������Ӱ��"����
���𰸡�c  ���ⶡװ����������еĶ�����̼��ˮ���� m-
���ⶡװ����������еĶ�����̼��ˮ���� m-![]() ƫС
ƫС
��������
(1)��ʵ��Ҫ�ⶨ�������ͭ������������Ӳ���Թ���װ��ͭ�ۣ���̼����Ʒ����ֻ̼������ͭ��Ӧ������ͭ��Ӧ���轫ͭת��Ϊ����ͭ��������ͭ�ڼ�����������������ͭ����ˣ���װ�ò�������Ϊ�������ɹ�ѡҩƷ��֪�����������ڶ������̴��²�����������Ӧ����Ҫ���ȣ���Ҫ���Ʒ�Ӧ���ʣ�ֻ�з�Һ©���ܿ��Ʒ�Ӧ���ʣ���ˣ�����װ��ѡ����з�Һ©����cװ�ã�����д��c��
���������ڶ������̴��²���������ˮ������д�� ��
��
(2)װ���찲װ�ڶ�װ�ü�ʯ�ҵĺ��棬���ⶡװ����������еĶ�����̼��ˮ����
��ʹ�ⶨ�����ȷ������д�����ⶡװ����������еĶ�����̼��ˮ������
(3)��Ӧ�����Ķ�����̼����Ϊ��m2-m1�����������غ㶨�ɵĺ��ʵ�ʣ���ѧ��Ӧǰ��Ԫ�������ԭ������̼�е�̼Ԫ�أ�������ͭ�ۣ���̼����Ʒ��̼��������̼��̼Ԫ������Ϊ��(m2-m1)��![]() ��100%=
��100%=![]() (m2-m1)����Ϊ̼����̼Ԫ����ɵģ����ԣ���Ʒ��̼������Ϊ��
(m2-m1)����Ϊ̼����̼Ԫ����ɵģ����ԣ���Ʒ��̼������Ϊ��![]() (m2-m1)����Ʒ��ͭ�۵�����Ϊ��m-
(m2-m1)����Ʒ��ͭ�۵�����Ϊ��m-![]() ������д��m-
�������m-![]() ��
��
(4)����װ��Ũ���ᣬ�������ռ��в����������е�ˮ����������װ���ң�ˮ�����ᱻ��װ�����գ�ʹ��Ӧ��������ֻ���ն�����̼���ӵĶ࣬����m2-m1��ֵ��Ӷ����¼������̼����������ͭ��������С���ᵼ�²��ͭ����������ƫС������д��ƫС��

 ����С��ʿ���������ϵ�д�
����С��ʿ���������ϵ�д�����Ŀ���ڿ�����ͨ��ʵ��̽����̼���Ƶ����ʣ���ش��������⡣
ʵ��һ | ʵ��� | ʵ���� | ʵ���� | |
ʵ����� |
|
|
|
|
ʵ������ | Һ����ֺ�ɫ | �������� | _______ | ___________ |
ʵ����� | ________ | _______ | ̼���������������Ʒ�Ӧ�� | ̼���������Ȼ�����Ӧ�� |
����Ŀ����ͼ��ʾ�����Ƚ��ιܼ��е�Һ������ձ����У��۲쵽�������Թ���һ��ʱ���ָ�ԭ״���ٽ��ι����е�Һ������ձ����У����������Թ��������и������ʽ��������ܹ��۲쵽����������ǣ�������
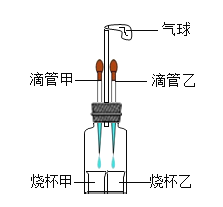
ѡ�� | �ιܼ� | �ձ��� | �ι��� | �ձ��� |
A | ˫��ˮ | �������� | ˮ | �������ƹ��� |
B | ϡ���� | ̼����� | ���� | ����������Һ |
C | ϡ���� | �� | ���� | ̼���� |
D | ʯ��ˮ | ϡ���� | ˮ | ����� |
A.AB.BC.CD.D
����Ŀ��һ��������ij������Z��16.0g����ǡ�÷�Ӧ������X��Y��W�������ֱ�Ϊ8.8g��5.6g��l0.8g����Ӧ�г������⣬������ʵIJ�����Ϣ���±���ʾ������![]() ��ʾ̼ԭ�ӣ�
��ʾ̼ԭ�ӣ�![]() ��ʾ��ԭ�ӣ�
��ʾ��ԭ�ӣ�![]() ��ʾ��ԭ�ӡ������й�˵���������
��ʾ��ԭ�ӡ������й�˵���������
���� | X | Y | Z | W |
������ʾ��ͼ |
|
| ���� |
|
��Է������� | ���� | ���� | 46 | ���� |
A.Z�Ļ�ѧʽΪC2 H6 O
B.�μӷ�Ӧ��Z������Ϊ9.2 g
C.�÷�Ӧ��Z��O2�Ļ�ѧ������֮��Ϊ1:3
D.��Ӧ�����漰�����ʾ�������Ԫ�أ��ҹ���������������������