题目内容
【题目】某化学兴趣小组利用电子天平对某种铁铜合金的成分进行测量。先取足量稀硫酸于烧杯中,再向其中加入28.0g合金样品开始计时,并将电子天平的读数记录在下表中,请回答下列问题:
操作 | 空烧杯 | 加入硫酸后 | 加入合金后5分钟 | 加入合金后12分钟 | 加入合金后21分钟 | 加入合金后40分钟 | 加入合金后3小时 |
读数(g) | 28.0 | 155.8 | 183.6 | 183.4 | 183.2 | 183.0 | 183.0 |
(1)根据电子天平读数和时间的关系分析,该反应进行过程中,氢气的产生速度有什么特点?__________。
(2)完全反应后,产生氢气的质量为____________克
(3)合金中铜的质量分数为多少_________________?
【答案】随着反应的进行,产生相同质量的氢气,需要的时间更多;40分钟后不再产生氢气 0.8 20%
【解析】
解:(1)由表格信息可知,随着反应的进行,产生相同质量的氢气,需要的时间更多;40分钟后不再产生氢气;
(2)完全反应后,产生氢气的质量为=28.0g+155.8g-183.0g=0.8g;
(3)设:合金中铁的质量为x。
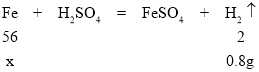
![]() x=22.4g
x=22.4g
合金中铜的质量分数为=![]() 。
。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】如图所示,若先将滴管甲中的液体滴入烧杯甲中,观察到气球明显鼓起,一段时间后恢复原状,再将滴管乙中的液体滴入烧杯乙中,气球又明显鼓起,用下列各组物质进行试验能够观察到上述现象的是( )
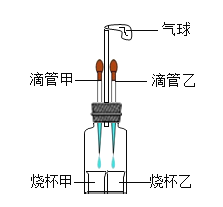
选项 | 滴管甲 | 烧杯甲 | 滴管乙 | 烧杯乙 |
A | 双氧水 | 二氧化锰 | 水 | 氢氧化钠固体 |
B | 稀硝酸 | 碳酸氢钾 | 盐酸 | 氢氧化钠溶液 |
C | 稀硫酸 | 铁 | 盐酸 | 碳酸钠 |
D | 石灰水 | 稀盐酸 | 水 | 硝酸铵 |
A.AB.BC.CD.D
【题目】在学习《金属资源保护》之前,我县某学校化学老师提前一周组织学生进行家庭小实验,探究铁制品锈蚀的条件。
(提出问题)铁制品锈蚀与什么因素有关?
(假设猜想)猜想一:铁制品锈蚀只与空气中的氧气有关
猜想二:铁制品锈蚀只与水有关
猜想三:铁制品锈蚀与____有关,且二者缺一不可。
(实验设计)某学习小组设计了如下的实验装置,将四颗相同的光亮无锈的铁钉置于以下四种不同的环境中,观察并记录实验现象。
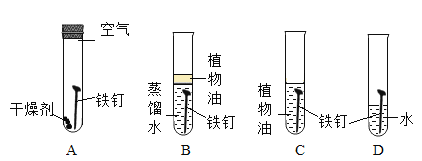
(实验现象)通过一周的观察,记录结果如下:
试管编号 | 第一天 | 第三天 | 第五天 | 第七天 |
A | 无现象 | 无现象 | 无现象 | 无现象 |
B | 无现象 | 无现象 | 无现象 | 无现象 |
C | 无现象 | 无现象 | 无现象 | 无现象 |
D | 无现象 | 轻微锈蚀但不明显 | 较严重锈蚀比较明显 | 严重锈蚀非常明显 |
(实验分析)
(1)根据A试管中的现象可知猜想____不正确。
(2)B试管中加植物油的作用是_____。
(实验结论)铁制品锈蚀的过程,实际上是铁与____等发生化学反应的过程。
(讨论交流)
(1)铁生锈后,由于生成的铁锈结构疏松,不能阻碍里层的铁锈蚀,因此铁制品可以全部锈蚀。铁锈的主要成分是______(用化学式表示)。
(2)据报道,世界上每年因腐蚀而报废的金属设备和材料相当于年产量的20%~40%,因此防止金属制品锈蚀意义重大。请你提出一条防止金属制品锈蚀的合理措施:______。