题目内容
【题目】根据高锰酸钾(KMnO4)制取氧气的实验探究,结合下图回答问题. 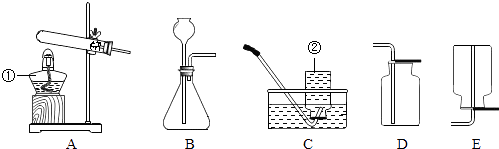
【反应原理】
(1)加热高锰酸钾制取氧气的化学方程式为 . 【仪器装置】
写出标有序号的仪器名称:① , ②;
(2)应选用的气体发生装置为(选填字母序号,下同),气体收集装置为 .
(3)【问题探究】 实验中,有同学发现对药品加热一段时间后收集不到氧气,可能的原因是 .
(4)【实验反思】 在清洗试管中的反应物残留物时,有的同学发现水溶液出现紫红色,有的发现水溶液呈墨绿色(锰酸钾溶于水所致),且同时有黑色的粉末状固体.你对水溶液出现紫红色这一现象的解释是 .
为了分离、回收反应残留物中的黑色粉末状固体,需对混合物溶液进行过滤.过滤操作时,需将圆形滤纸折叠.下列滤纸折叠过程图示中,正确的是(选填“甲”或“乙”).
甲:A→B→C 乙:A→B→D
(5)有同学发现,不慎将高锰酸钾粘到了手上,会留下一时洗不掉的褐色斑痕.老师说,这是高锰酸钾氧化作用对皮肤的腐蚀所致. 针对这个案例,在实验前你想提醒同学们注意的是 .
(6)【课外延伸】 一同学上网查阅,知道高锰酸钾还有其他用途.如用板材装修的新房内,往往有一股刺鼻的气味,这是室内污染的主要成分之一﹣﹣甲醛引起.可用下列反应来测定甲醛(用R表示)含量是否超标:
4KMnO4+5R+6H2SO4=2K2SO4+4MnSO4+5CO2↑+11H2O
试确定R的化学式 .
【答案】
(1)2KMnO4 ![]() K2MnO4+MnO2+O2↑;酒精灯;集气瓶
K2MnO4+MnO2+O2↑;酒精灯;集气瓶
(2)A;C或D
(3)装置漏气(合理均可)
(4)未完全反应的高锰酸钾溶于水所致;甲
(5)避免药品与皮肤直接接触,实验要注意安全等
(6)CH2O
【解析】解:【反应原理】 加热高锰酸钾生成锰酸钾、二氧化锰和氧气,方程式是2KMnO4 ![]() K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
所以答案是:2KMnO4 ![]() K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
【仪器装置】(1)根据常用仪器可知标号仪器分别是酒精灯、集气瓶;
所以答案是:酒精灯;集气瓶;(2)高锰酸钾制取氧气需加热,故选择发生装置A;氧气不易溶于水,故可用排水法收集,氧气的密度比空气大,故可用向上排空气法收集;
所以答案是:A;C或D;
【问题探究】
如果装置漏气,产生的气体泄漏会影响气体的收集;对药品加热一段时间后收集不到氧气,可能的原因是试管口塞子未塞紧,气体从试管口逸出;
所以答案是:装置漏气(合理均可);
【实验反思】(1)高锰酸钾溶于水显紫红色,所以清洗试管水溶液出现紫红色,可能是未完全反应的高锰酸钾溶于水所致;过滤时滤纸对折两次,打开一边三层,一边是一层;
所以答案是:未完全反应的高锰酸钾溶于水所致;甲;(2)依据题目所给信息可知:高锰酸钾具有氧化作用对皮肤有腐蚀作用,所以从实验的安全角度考虑,要提醒学生注意安全,避免药品药品与皮肤直接接触;
所以答案是:避免药品与皮肤直接接触,实验要注意安全等;
【课外延伸】
依据化学反应前后原子的种类和个数不变,反应前的原子个数是:K:4,Mn:4,O:40,H:12,S:6;反应后的原子个数是:K:4,Mn,4,O:45,H:22,S:6,C:5,故R有1个碳原子,2个氢原子,1个氧原子构成,由碳、氢、氧元素组成的物质,通常其化学式的组成元素按照碳、氢、氧的顺序排列;
所以答案是:CH2O
【考点精析】关于本题考查的混合物的分离方法和质量守恒定律及其应用,需要了解混合物的分离:1、过滤法:分离可溶物 + 难溶物2、结晶法:分离几种可溶性物质;①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏才能得出正确答案.

【题目】下表是100g某品牌板栗的部分营养成分.
总热量 | 蛋白质 | 糖类 | 油脂 | 钠 | 维生素C |
1016kJ | 5.1g | 11.3g | ? | 4.6mg | 3.3mg |
(1)食物的成分主要有六大类营养素,上表中没有涉及的营养素是 ;
(2)假设该板栗中的钠元素以氯化钠的形式存在,则100g该板栗中,氯化钠的质量为mg(计算最后结果精确到0.1,下同);
(3)假设食物的热量是由蛋白质、糖类、油脂提供的,单位质量的蛋白质、糖类、油脂完全氧化放热约为:油脂 39.3kJ/g 蛋白质 18kJ/g 糖类 15.6kJ/g.根据此数据计算,理论上100g该板栗中油脂的质量为g.