题目内容
【题目】中国是全球抗生素滥用最严重的国家之一,需引起我们重视。 环丙沙星是常用的一种抗生素,其说明书中部分内容如图。

(1)环丙沙星属于____(填“有机”或“无机”)化合物。
(2)环丙沙星分子中碳、氢、氧的原子个数比为____。
(3)环丙沙星中氟元素的质量分数为____(结果精确到 0.1%)。
(4)患者一个疗程共服用了____片环丙沙星片。
【答案】有机 17∶18∶3 5.7% 120
【解析】
(1)一氧化碳、二氧化碳、碳酸、碳酸盐等除外,含有碳元素的化合物是有机物,故环丙沙星属于有机化合物。
(2)由环丙沙星的化学式看出,环丙沙星分子中碳、氢、氧的原子个数比为17∶18∶3。
(3)环丙沙星中氟元素的质量分数为:![]() ×100%≈5.7%。
×100%≈5.7%。
(4)根据题给信息可知,每片0.25g,每次1g,每日三次,10天一疗程,患者一个疗程共服用了4×3×10=120片环丙沙星片。

【题目】化学学科实践活动课上,老师拿来一包粉末。它是由长期放置在空气中的铁粉和久置的碱石灰干燥剂混合而成,让同学们设计实验进行探究。
(提出问题)固体样品的成分是什么?
(查阅资料)(1)碱石灰干燥剂是CaO和NaOH的混合物。(2)CaCl2溶液显中性。
(猜想与假设)固体样品中可能含有 Fe、Fe2O3、CaO、NaOH、Ca(OH)2、Na2CO3和_____等七种物质。
(进行实验)
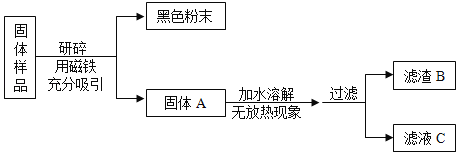
甲组同学对滤渣B的成分进行探究,记录如下:
实验操作 | 实验现象 | 实验结论及化学方程式 |
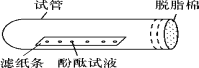
取少量滤渣B于试管中,加入足量稀盐酸,将生成的气体通入澄清的石灰水中 | ①_______________ ②_______________ | 结论:滤渣B中有 Fe2O3,CaCO3。 实验操作中Fe2O3与稀盐酸反应的化学方程式为:____________________ |
乙组同学对滤液C的成分进行探究,记录如下:
实验操作 | 实验现象 | 实验结论及化学方程式 |
取少量滤液C于试管中,加入过量CaCl2溶液,静置,向上层清液中滴加无色酚酞试液,振荡 | ①有白色沉淀生成 ②酚酞试液由无色变成红色 | 滤液C中有__________; 滤液C中的物质与CaCl2反应的化学方程式是_________________ |
(解释与结论)(1)乙组同学实验中加入过量CaCl2溶液的目的是________________________
(2)通过以上实验探究,该固体样品中能确定一定含有的成分是___________________。