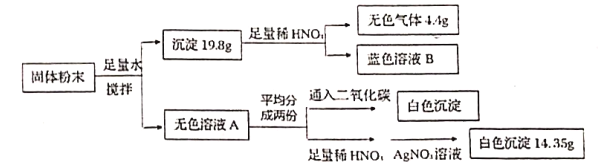
题目内容
【题目】钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注.某化学兴趣小组对Mg、Ti、Ag的金属活动性顺序进行探究.
[提出假设]A.Ti>Mg>Ag; B.Mg>Ag>Ti; C._____.
[查阅资料]在相同条件下,金属与酸反应,产生气泡的速度越快,则该金属活动性越强.
[实验设计]同温下,取大小相同的这三种金属薄片,分别投入等体积、等质量分数的足量稀盐酸中,观察现象.请填空:
(1)三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是_____.
(2)根据下表中的实验现象填空:
Ti | Mg | Ag | |
实验现象 | 产生气泡速度缓慢 | 产生气泡速度快 | 无任何现象 |
[结论]假设_____正确(填“A”或“B”或“C”)
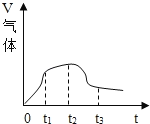
(3)在做镁条与稀盐酸反应过程中观察到产生气体体积与反应时间有如图所示关系:
则t1~t2时间内反应速率逐渐加快的主要原因是_____. t2~t3时间内反应速率逐渐减慢的原因是_____.
(4)在[实验设计]中,如果所用盐酸的溶质质量分数不同,是否一定能够得出正确结论?_____(填“是”或“否”),理由是_____.
(5)你是否还知道其他方法来比较这三种金属的活动性(可供选择的药品:Ti、Mg、Ag、TiCl2溶液、MgCl2溶液、AgNO3溶液).
①_____;②_____.
【答案】Mg、Ti、Ag 除去表面的氧化层 C 反应放热,溶液温度升高使反应速率加快; 盐酸溶液的浓度逐渐降低 否; 反应物的浓度不同,也会影响反应速度 金属Mg、Ag分别和TiCl2溶液反应; MgCl2溶液、AgNO3溶液分别和金属Ti反应
【解析】
(1)较活泼的金属如镁、铝等能与空气中的氧气在金属表面形成一层氧化膜,影响与酸的反应,因此需要用沙纸进行打磨除去表面的氧化层;
故答案为:③;
(2)金属镁与酸反应要比钛与酸反应更为剧烈,所以金属镁的活动性比钛强;而银不与稀盐酸反应,为三种金属中活动性最弱的金属;
所以三种金属的活动性顺序为:Mg、Ti、Ag;故答案为:C;
(3)镁与盐酸反应是放热反应,会使反应溶液温度升高,温度越高化学反应速率越快,随着盐酸的反应盐酸的溶质质量分数会减小,溶质质量分数减小,盐酸与镁的反应速率会下降;
故答案为:反应放热,溶液温度升高使反应速率加快;盐酸溶液的浓度逐渐降低;
(4)由于酸的浓度不同也会影响到酸与金属的反应,因此在比较金属的活动性时,一定要使用浓度相同的稀盐酸;
故答案为:否;反应物的浓度不同,也会影响反应速度.
(5)验证金属活动顺序时如果是三种金属则可以采用“两金夹溶液”或“两液夹一金”的方法既按金属活动顺序排序后,三种金属两端的用金属中间的用盐溶液或两端的用盐溶液中间的用金属;
故答案为:金属Mg、Ag分别和TiCl2溶液反应;MgCl2溶液、AgNO3溶液分别和金属Ti反应;

【题目】“打好蓝天保卫战、治理大气污染”是提升人民生活质量的重要工作。二氧化硫(SO2)是一种大气污染物。工业上可以利用海水对二氧化硫进行吸收利用,变害为宝。其工艺流程见图:
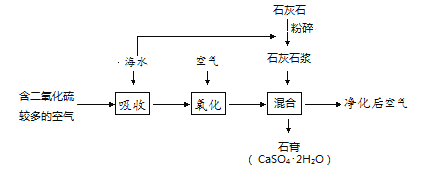
(1)流程中将石灰石加水制成石灰石浆的目的是_______。
(2)其中硫元素的化合价在反应前后的变化为________。.
(3)为了提升脱硫率(脱硫率是指已除去的二氧化硫的量占总二氧化硫量的百分比)与温度、烟气中SO2浓度的关系,技术人员进行了探究实验。实验结果如下:
实验序号 | 温度/℃ | 烟气中SO2浓度/10-2gL-1 | 脱硫率 |
Ⅰ | 23 | 2.5% | 99.5 |
Ⅱ | 23 | 3.2% | 97.1 |
Ⅲ | 40 | 2.5% | 94.3 |
由表中实验数据可得出的结论是_______。