题目内容
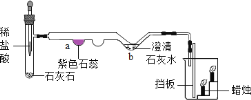
【题目】一包固体粉末可能含有NaNO3、CaCO3、NaOH、CuCl2、NaCI和Ca(NO3)2中的一种或几种.为确定其组成,某同学设计了如下实验方案.下列判断正确的是
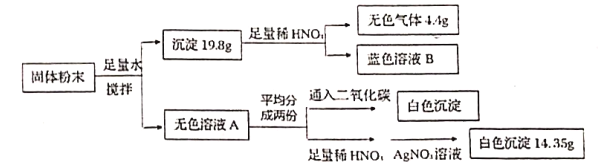
A. 该混合物中一定含有CaCO3、NaOH、CuCl2、Ca(NO3)2
B. 蓝色溶液B的溶质有2种
C. 无色溶液A呈中性
D. 该混合物中一定含有NaCI可能含有NaNO3
【答案】A
【解析】
根据题意NaNO3、CaCO3、NaOH、CuCl2、NaCI和Ca(NO3)2中的一种或几种,设计了如下实验方案进行探究:固体粉末加入足量的水充分溶解,得到19.8g沉淀,和无色滤液;根据无色滤液可以推导出滤液无氯化铜;根据有19.8g沉淀可以推导出肯定有碳酸钙;沉淀加入稀硝酸后有无色气体(二氧化碳),蓝色溶液(硝酸铜),可得沉淀中有氢氧化铜;故原固体中有氯化铜;氯化铜与氢氧化钠反应才会有沉淀产生,故原固体肯定有氢氧化钠;往滤液中通入二氧化碳有沉淀产生,说明滤液中有钙离子,故原白色固体中有硝酸钙;往无色滤液中加入稀硝酸后滴加硝酸银,产生白色沉淀,故滤液中有氯离子,但不能证明是否有氯化钠,因为氯化铜中有氯离子;以上是定性分析,可以得出原固体粉末一定有:CaCO3、NaOH、CuCl2、Ca(NO3)2;不能确定是否有NaNO3,NaCl,而硝酸钠没有试剂去检验,故不确定,但是氯离子可以定量计算来判断是否有。因为沉淀19.8g有两种成分,通过产生的无色气体求出碳酸钙质量,再有总质量减去碳酸钙求得氢氧化铜的质量;再由氢氧化铜的质量求出氯化铜中离子的的质量,最后对比氯化银中氯的质量即可知道原固体中是否有氯化钠。
定性分析如上
定量计算如下:
解设碳酸钙的质量为X,氯化铜的质量为Y;
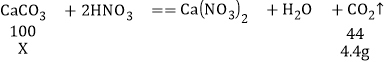
![]()
![]()
氢氧化铜的质量为:19.8g-10g=9.8g。
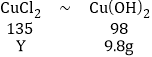
![]()
氯化铜中氯元素的质量为:![]()
氯化银中氯元素的质量为:![]()
又因为分两份来作实验,故无色滤液中的氯离子质量为:![]()
比较可知两者相同,故无色滤液中的氯离子只有氯化铜来提供;可得原固体中无氯化钠。
A. 该混合物中一定含有CaCO3、NaOH、CuCl2、Ca(NO3)2,说法正确,故符合题意;
B. 蓝色溶液B中有硝酸铜,硝酸钙,还有剩余的硝酸,故溶质有3种,说法错误,不符合题意;
C. 因为会发生氯化铜与氢氧化钠的反应,由无色溶液A可知,完全反应或者碱过量,故不一定为中性,有可能是碱性,说法错误,故不符合题意。
D. 经过定量计算可得该混合物中一定没有NaCl,可能含有NaNO3。故说法正确,故不符合题意;
故选A

【题目】看图并请从A或B两题中任选1个作答,若两题均作答,只一组计分。
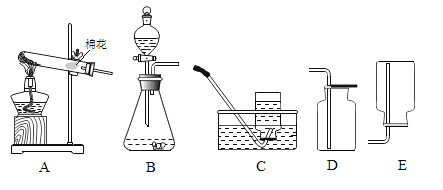
A | B |
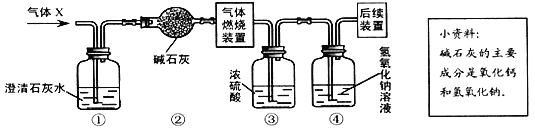
(1)用装置A制备一瓶氧气,其制备原理为_____(写出化学反应的方程式)。 (2)氧气可用C装置收集,还可以用__收集(填写装置编号)。 | (1)装置B可用于实验室制取二氧化碳。写出制取CO2反应的化学方程式为__。 (2)收集二氧化碳可选择___(填写装置编号)。 |
【题目】钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注.某化学兴趣小组对Mg、Ti、Ag的金属活动性顺序进行探究.
[提出假设]A.Ti>Mg>Ag; B.Mg>Ag>Ti; C._____.
[查阅资料]在相同条件下,金属与酸反应,产生气泡的速度越快,则该金属活动性越强.
[实验设计]同温下,取大小相同的这三种金属薄片,分别投入等体积、等质量分数的足量稀盐酸中,观察现象.请填空:
(1)三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是_____.
(2)根据下表中的实验现象填空:
Ti | Mg | Ag | |
实验现象 | 产生气泡速度缓慢 | 产生气泡速度快 | 无任何现象 |
[结论]假设_____正确(填“A”或“B”或“C”)
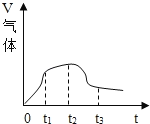
(3)在做镁条与稀盐酸反应过程中观察到产生气体体积与反应时间有如图所示关系:
则t1~t2时间内反应速率逐渐加快的主要原因是_____. t2~t3时间内反应速率逐渐减慢的原因是_____.
(4)在[实验设计]中,如果所用盐酸的溶质质量分数不同,是否一定能够得出正确结论?_____(填“是”或“否”),理由是_____.
(5)你是否还知道其他方法来比较这三种金属的活动性(可供选择的药品:Ti、Mg、Ag、TiCl2溶液、MgCl2溶液、AgNO3溶液).
①_____;②_____.