题目内容
【题目】如图为a、b两种物质的溶解度曲线。请根据图中内容回答下列问题:
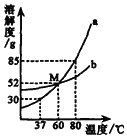
(1)曲线a和b的交叉点M表示的含义是_____。
(2)80℃时a物质的溶解度是_____g,40ga物质溶于50g水中所形成的溶液是_____(选填“饱和”或“不饱和”)。
(3)当b中混有少量a时,可采用_____提纯b。
【答案】在60℃时,a、b的溶解度相等 85; 不饱和 蒸发结晶
【解析】
(1)由溶解度曲线可知,曲线a和b的交叉点M表示的含义是:在60℃时,a、b的溶解度相等;
(2)80℃时a物质的溶解度是85g,40ga物质溶于50g水中所形成的溶液是不饱和溶液,因为此温度下50g水中最多溶解a物质42.5g就达到饱和状态;
(3)当b中混有少量a时,可采用蒸发结晶提纯b,因为b的溶解度随温度的升高变化比a小。

 阅读快车系列答案
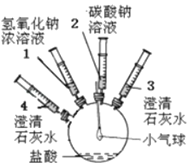
阅读快车系列答案【题目】某实验小组的同学要探究酸碱盐中碳酸钠的化学性质,设计了如下实验装置及方案:
实验装置 | 实验步骤及操作 | 实验现象 |
| ①将注射器2中的溶液推入盛有稀盐酸的瓶中,至不再有气泡产生。 | 气球变瘪 |
②将注射器3稍稍向外拉 | 澄清石灰水变浑浊 | |
③将注射器1中的溶液推入瓶中 | 气球鼓起 | |
④____ | 无明显现象 | |
⑤将注射器4中的溶液推入瓶中 |
(1)步骤①中气球变瘪的原因_____;
(2)步骤②发生反应的方程式_____;
(3)步骤④的操作是_____,其目的是_____;
(4)步骤⑤中实验现象_____;反应方程式_____。
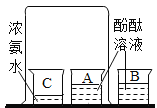
【题目】氢氧化钠和氢氧化钙是两种常见的碱,化学实验活动课上,同学们进行了如图所示的实验。
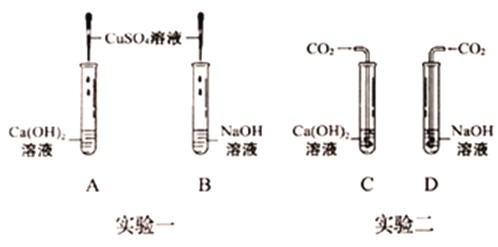
(1)实验一中,B试管中发生反应的化学方程式为_____。
A、B两支试管中共同的实验现象是_____。
(2)实验二中,C试管中有白色沉淀生成,该白色沉淀是_____(填化学式)。D试管中无现象,为了探究通入二氧化碳后D试管中溶质的成分,同学们进行了如下探究。
(提出猜想)猜想1:溶质是NaOH。
猜想2:溶质是NaOH和Na2CO3
猜想3:溶质是Na2CO3
实验操作 | 实验现象 | 实验结论 |
①取D中少量溶液于试管中加入过量稀盐酸 | _____ | 猜想1不成立 |
②取D中少量溶液于另一试管中,加入过量的Ca(OH)2溶液,过滤,取滤液加入酚酞溶液 | 产生白色沉淀,酚酞溶液变红 | 猜想2成立 |
(反思与评价)I.小军评价实验操作②中加入Ca(OH)2溶液不正确,理由是_____。
若要验证猜想2成立,需将Ca(OH)2溶液换成_____溶液。
Ⅱ在实验室中氢氧化钠固体密封保存的原因是_____(用文字叙述)
【题目】某实验学校初三兴趣小组利用如下装置(部分固定装置已略去)。制备氮化钙,并探究其化学式
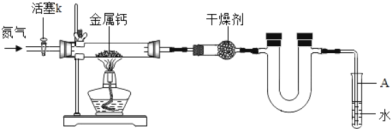
(1)反应过程中末端导管必须插入试管A的水中,目的是_____。
(2)制备氮化钙的操作步骤是:①打开活塞k并通入N2;②点燃酒精灯,进行反应;③反应结束后,_____;④拆除装置,取出产物。
(3)数据记录如下:
空硬玻璃管质量m0/g | 硬玻璃管与钙的质量m1/g | 硬玻璃管与产物的质量m2/g |
114.8 | 120.8 | 122.2 |
①计算得到化学式(实验式)CaxN2,其中x=_____。
②若通入的N2中混有少量O2,如上计算得到的x的值_____ (填写“偏大”、“偏小”、“不变”),判断依据是_____。