题目内容
【题目】化学兴趣小组在实验室发现一瓶氢氧化钠溶液,瓶口有少量白色固体且玻璃瓶塞打不开,这一情况激起了他们浓厚的兴趣,于是展开了如下探究:
(提出问题)
瓶口白色固体的成分是什么?
(查找资料)
(1)玻璃中含有二氧化硅(SiO2),试剂瓶身经抛光处理,不易反应,而瓶口和玻璃塞上的磨砂将二氧化硅裸露出来。
(2)二氧化硅能与氢氧化钠溶液反应,![]()
(3)硅酸钠(Na2SiO3)是一种白色固体,有很强的粘合性,可溶于水,溶液呈碱性;硅酸钠溶液能与强酸反应,如:![]() (白色);硅酸钠溶液能与氯化钙溶液反应:
(白色);硅酸钠溶液能与氯化钙溶液反应:![]() (白色)。
(白色)。
(作出猜想)
白色固体的成分是:1.硅酸钠:Ⅱ,硅酸钠和碳酸钠:Ⅲ硅酸钠、碳酸钠和氢氧化钠
(实验探究)
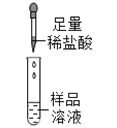
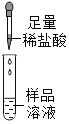
取一定量白色固体溶于适量水中形成样品溶液,分组进行如下实验并相互评价:
实验操作 | 实验现象 | 结论与评价 | ||
第 一 组 |
| 有气泡冒出且产生白色沉淀 | 同学们认为猜想____不成立 | |
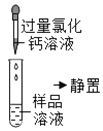
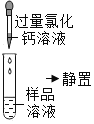
第 二 组 | 第 一 步 |
| 产生白色沉淀 | 第一组的同学认为:此步骤还不能准确判断出原固体的成分。原因是________ |
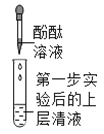
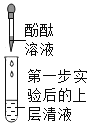
第 二 步 |
| _______ | 大家一致认为: 猜想Ⅱ成立 | |
(解释结论)
猜想Ⅱ中碳酸钠的来源是________(用化学方程式表示)。
(反思交流)
(1)有同学认为,第二组实验中不能用氢氧化钙溶液代替氯化钙溶液,理由_______;
(2)氢氧化钠溶液必须密封保存,且试剂瓶只能用橡胶塞或软木塞。
【答案】I 氢氧化钠与氯化钙溶液不反应,无法确定是否存在 溶液不变色 ![]() 氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,影响检验氢氧化钠
氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,影响检验氢氧化钠
【解析】
[实验探究]硅酸钠溶液能与强酸反应,如:Na2SiO3+2HCl═2NaC1+H2SiO3↓ (白色),氯化钙和碳酸钠反应会生成碳酸钙沉淀和氯化钠,不会与氢氧化钠反应,酚酞遇碱变红色,所以
实验操作 | 实验现象 | 结论与评价 | ||
第一组 |
| 有气泡冒出且产生白色沉淀 | 同学们认为猜想I不成立 | |
第二组 | 第一步: |
| 产生白色沉淀 | 第一组的同学认为:此步骤还不能准确判断出原固体的成分,原因:氢氧化钠与氯化钙不会反应,无法确定是否存在 |
第二步: |
| 溶液不变色 | 大家一致认为: | |
[解释结论]猜想Ⅱ中碳酸钠的来源是氢氧化钠和二氧化碳反应生成碳酸钠和水,化学方程式为:CO2+2NaOH=Na2CO3+H2O;
[反思交流](1)有同学认为,第二组实验中不能用氢氧化钙溶液代替氯化钙溶液,理由是:氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,影响检验氢氧化钠。
故答案为:[实验探究]I;氢氧化钠与氯化钙不会反应,无法确定是否存在;溶液不变色;
[解释结论]CO2+2NaOH=Na2CO3+H2O;
[反思交流](1)氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,影响检验氢氧化钠。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】某化工厂用石灰石和废铜屑等设计生产石青、波尔多液的工艺流程如下:
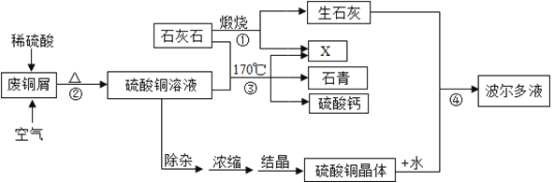
一、产品制备
(1)流程图中X的化学式为______;
(2)反应②分两步进行,化学方程式分别为:第一步______,第二步______;
(3)硫酸铜的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
溶解度/g | 14.3 | 17.4 | 20.7 | 25.0 | 28.5 | 33.3 | 40.0 | 55.0 | 75.4 |
蒸发浓缩后热溶液经处理大量析出晶体,温度到达30℃时,剩余硫酸铜溶液的溶质质量分数为______;待结晶完毕后,滤出晶体,用少量冰水洗涤2-3次,用冰水洗涤的目的是:Ⅰ是除去晶体表面的杂质; Ⅱ是______。
(4)反应④中硫酸铜、生石灰和水制备波尔多液,其总反应化学方程式为______。
二、组成测定
资料:石青的化学式是aCuCO3·bCu(OH)2,已知Cu(OH)2和CuCO3都能受热分解,分别生成两种氧化物,其中Cu(OH)2的分解温度为66℃到68℃,CuCO3的分解温度为200℃到220℃。
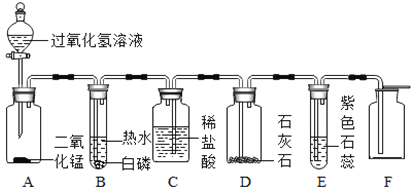
为测定其组成,小组同学称取石青样品34.6g,用下图装置进行实验。

(5)洗气瓶A中氢氧化钠溶液的作用是______;B中所装液体为______。
(6)现控制C装置中的温度为250℃对石青进行热分解,直至C装置中剩余固体质量不再变化为止,再缓缓通入一段时间空气后,冷却后装置D增重1.8g,装置E增重8.8g。通过计算可得 a︰b=______。
(7)若缺少F装置,测得的a︰b的值会______(选填“偏大”、“偏小”、“不变”)。
三、产物探究
取22.2g样品,对固体进行热分解实验,测定剩余固体质量与分解温度之间关系如图。请回答下列问题:
(8)0~66℃固体质量没有发生变化的原因可能是_______。
(9)m=________。
(10)若将mg剩余固体继续加热到更高的温度,发现固体质量减少了2.4g后质量不再改变,写出此过程中可能发生反应的化学方程式:______。
【题目】下表是某同学探究金属活动性顺序的实验报告,请你在空白处填空。
实验步骤 | 实验现象 | 反应的化学方程式 |
(1)将锌片、铜片分别投入到盛有稀H2SO4的试管中。 | _____ | _____ |
(2)将铜片投入到盛有AgNO3溶液的试管中。 | 在铜片的表面覆盖了一层银白色物质,溶液呈_____色 | _____ |
(3)结论:Zn、Cu、Ag三种金属由强到弱的活动顺序为_____。 | ||