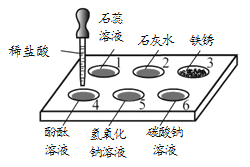
题目内容
【题目】如图是实验室用来制取气体的装置,回答下列问题。
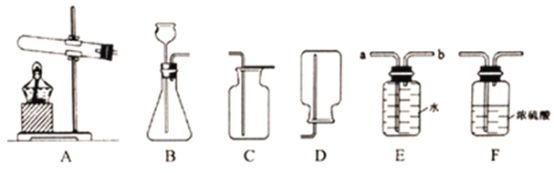
(1)实验室用高锰酸钾制取氧气,发生装置可选用_____(填字母)。若用E装置收集氧气,气体应从_________(填“a”或“b”)端通入。
(2)实验室制取二氧化碳的化学方程式为_____,若想制取并收集一瓶干燥的二氧化碳,应选择的实验装置连接顺序是_____(填字母)。收集二氧化碳时,导管应伸至接近集气瓶底部的原因是_____。
【答案】AbCaCO3+2HCl=CaCl2+H2O+CO2↑BFC便于排净集气瓶中的空气
【解析】
根据气体制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关进行分析解答即可。
(1)实验室用高锰酸钾制取氧气,是固体加热型反应,故发生装置可选用A;用E装置收集氧气,是排水法,故气体应从b端通入。
(2)实验室制取二氧化碳是碳酸钙和稀盐酸的反应,化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑,要想制取并收集一瓶干燥的二氧化碳,是固液常温型反应,气体通过浓硫酸干燥,采用向上排空气法收集,故应选择的实验装置连接顺序是BFC;收集二氧化碳时,导管应伸至接近集气瓶底部是为了便于排净集气瓶中的空气。

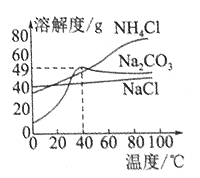
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。请回答下列问题:
X | Y | ||||||
Z | W | ||||||
(1)X能形成多种单质,写出其中两种单质的名称_____。
(2)Z元素的原子结构示意图是_____。
(3)元素的非金属性为(原子的得电子能力):Y______W(填“大于”或“小于”)。
(4)W位于周期表的_____周期,_____主族,该元素最高价氧化物对应水化物的化学式是_____。(中心元素可用字母W表示)
(5)“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存和利用。常利用NaOH溶液来“捕捉”CO2,过程如图所示(部分条件及物质未标出)。

请根据“捕捉”CO2过程图回答问题:
①加入A物质的化学式是_____;分离操作Ⅰ的名称是_____。
②可循环利用的B物质中一定含有的物质是_____。
③该过程中还可循环利用的物质是_____。
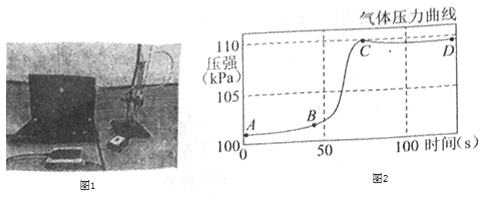
【题目】用下图所示装置,在常温下分别进行探究可燃物燃烧条件和氢氧化钠性质的实验。
已知:白磷的着火点为40℃
内容 装置 | (实验1) 探究可燃物燃烧条件 | (实验2) 探究氢氧化钠性质 |
| I. A中盛有H2O2溶液,B中盛有MnO2,C中盛有80℃的热水和一小块白磷 | I. A中盛有滴有酚酞的 NaOH溶液,B中充满CO2,C中盛有稀硫酸 |
II. 打开分液漏斗活塞,将A中溶液滴加到B中,关闭分液漏斗活塞并打开K | II. 打开分液漏斗活塞,将A中溶液滴加到B中,关闭分液漏斗活塞。充分反应后,打开K |
(1)H2O2溶液与MnO2接触时,发生反应的化学方程式为______。
(2)实验1中,打开K后观察到C中白磷燃烧。该实验证明可燃物燃烧的条件之一是_______。
(3)实验2中,对于所观察到的以下三个实验现象:C中部分液体沿导管流入B中,B中有气泡生成,B中溶液由红色变为无色。解释产生上述现象的主要原因_______(用化学方程式表示)。