题目内容
【题目】(1)食醋中的主要成分是醋酸(CH3COOH)、水和氯化钠。以上涉及的物质中共有______种元素。其中醋酸中碳元素与氧元素的质量比为________,1个醋酸分子中含有氢原子的个数为______,氯化钠是由阴离子和阳离子结合成的,其中阴离子符号为______。
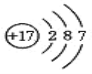
(2)根据如图的原子结构示意图判断,该元素的原子的核电荷数为_____,在化学反应中这种原子容易得___个电子,形成氯离子。
【答案】5 3:4 4 Cl- 17 1
【解析】
(1)醋酸(CH3COOH)是由碳、氢、氧三种元素组成的,水是由氢、氧两种元素组成的,氯化钠是否由钠、氯两种元素组成的,共涉及碳、氢、氧、钠、氯五种元素;醋酸中碳元素与氧元素的质量比为(12×2):(16×2)=3:4,1个醋酸分子中含有4个氢原子;氯化钠是由钠离子和氯离子构成的,阴离子是氯离子,其离子符号为:Cl-。
故答案为:5;3:4;4;Cl-。
(2)由原子结构示意图判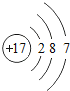 可知,圆圈内的数字是17,该元素的原子的核电荷数为17;最外层弧线上的数字是7,原子最外电子层上有7个电子,在化学反应中易得到1个电子而形成阴离子。
可知,圆圈内的数字是17,该元素的原子的核电荷数为17;最外层弧线上的数字是7,原子最外电子层上有7个电子,在化学反应中易得到1个电子而形成阴离子。
故答案为:17;1。

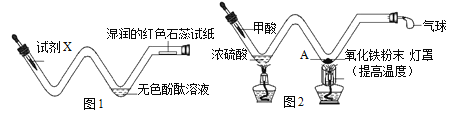
【题目】碳酸氢钠(NaHCO3)是焙制糕点所用的发酵粉的主要成分之一。青竹湖化学兴趣小组的同学们,对 NaHCO3固体的加热分解展开探究。
(提出问题)碳酸氢钠固体加热分解的产物是什么?
(查阅资料)①碳酸氢钠固体受热不稳定,易分解生成碳酸钠(Na2CO3)等
②Na2CO3固体受热不易分解
③CO2能使澄清石灰水变浑浊,而CO不能
(做出猜想)猜想一:产物是Na2CO3、H2O、CO2
猜想二:产物是Na2CO3、H2O、CO
(实验探究)实验操作
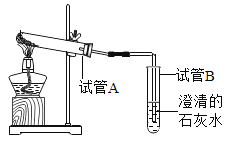
实验操作 | 现象 | 结论 |
如上图,取8.4g干燥的碳酸氢钠粉末于试管A中,用酒精灯加热至固体质量不再变化。 | A试管口出现大量水珠 | 产物中有_____ |
B试管中_____ | 产物中有CO2 |
(实验结论)猜想一成立。
(交流与讨论)
(1)小氧同学在实验结束后,先熄灭酒精灯,后将导管移出试管B他这样操作可能导致的后果是_____。
(2)小硅同学在实验结束后,通过计算得出试管A中剩余固体(不含水分)的质量为_____g。
(3)小铝同学提出不需要进行实验探究,从理论上分析就能知道猜想二不成立,他的理由是_____。
(4)小铁同学想除去混在Na2CO3固体中的少量 NaHCO3杂质,从而得到纯净的Na2CO3固体。请你结合以上实验探究的结论,帮助小铁同学设计一个简单且合理的实验方案:_____(简单描述实验操作即可)。