题目内容
【题目】化学小组的同学对氧气和二氧化碳的制取进行如下探究,请你共同参与。
探究一、研究氧气的制取
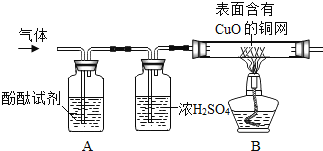
小组同学利用如图装置完成氧气的制取。
(1)写出标号仪器名称:①_____。
(2)现有如下几种物质:
A 氯化钠 B 水 C 氯酸钾 D 过氧化氢 E 高锰酸钾
①从元素组成角度推测,上述物质不可能制得氧气的是_____(填字母序号)。
②从节能角度考虑,实验室制取氧气优选的药品是_____(填字母序号)。
(3)下列说法中,正确的是_____(填字母序号)。
A 选用图中A、C装置制取氧气实验结束后,应先撤导管,再熄灭酒精灯
B 用排水法收集氧气时,刚有气泡冒出即可立即收集气体
C 用向上排空气法收集氧气时,应将带火星木条伸入集气瓶中验满
(4)实验室用过氧化氢溶液和二氧化锰制取氧气时,发生反应的化学方程式为_____;若锥形瓶中反应太剧烈,可进行的改进是_____(填字母序号)。
A 控制滴加液体的量和速率 B 用体积较小的锥形瓶 C 加热锥形瓶 D 将过氧化氢溶液稀释
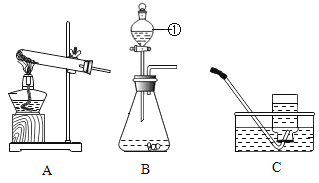
【答案】分液漏斗 A D A 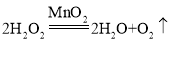 AD
AD
【解析】
(1)据图可知仪器①是分液漏斗;
(2)①由质量守恒定律可知,制备氧气的物质中必须含有氧元素,而氯化钠中不含氧元素,所以不能用于制备氧气。故选A;
②用水制备氧气需要通电,消耗电能;用高锰酸钾或氯酸钾制取氧气需要加热,而过氧化氢制备氧气是在常温下进行的,所以从节能角度考虑,实验室制取氧气优选的药品是过氧化氢。故选D;
(3)A、选用图中A、C装置制取氧气实验结束后,应先撤导管,再熄灭酒精灯,以防冷水倒吸、炸裂试管,选项说法正确;
B、用排水法收集氧气时,导管口刚开始排出的是装置内的空气,需要等到导管口的气泡连续均匀冒出时才能收集气体,选项说法错误;
C、用向上排空气法收集氧气时,应将带火星木条放在集气瓶口验满,选项说法错误。故选A。
(4)在二氧化锰的催化作用下,过氧化氢分解为水和氧气,反应的化学方程式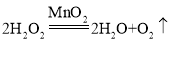 ;若锥形瓶中反应太剧烈,可进行的改进是控制滴加液体的量和速率或加水稀释过氧化氢溶液。故选AD。
;若锥形瓶中反应太剧烈,可进行的改进是控制滴加液体的量和速率或加水稀释过氧化氢溶液。故选AD。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
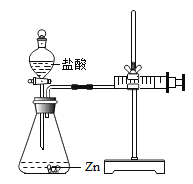
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a.可能与金属本身的性质有关
b.可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入等质量、等浓度的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡。写出锌与盐酸发生反应的化学方程式为_______________________.
从实验现象可判断:金属活动性Zn_______Fe(填“<”、’“=”或“>”).
【得出结论】金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是_______.
实验(2)为探究猜想b,小组同学设计如上图的装置进行实验,其中注射器的作用是_______.
所用药品、实验数据如下表:
实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
1分钟 | 1﹣2分钟 | 2﹣3分钟 | 3﹣4分钟 | 4﹣5分钟 | 前5分钟共收集气体 | |||
Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 48.5 |
Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【得出结论】金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是_________________.
【反思评价】根据表中实验Ⅱ数据分析,请解释锌与盐酸发生反应由慢到快、再由快到慢的原因是_________________________.
【拓展延伸】通过以上探究,你认为金属与盐酸反应的剧烈程度还可能与哪些因素有关?请你帮助他们继续探究.(只要求提出一种影响快慢的相关假设因素及实验方案)
【假设】________________________________.
【实验方案】_____________________________.