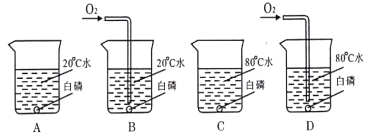
题目内容
【题目】有A、B、C、D四种物质,其中A是黑色氧化物粉末,B是光亮的紫红色物质,C、D都是含一种溶质的溶液,它们有如下反应和转化关系(如图)。请回答下列问题:
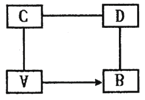
(1)请写出A、B的化学式A______;B______。
(2)写出C与D反应的化学方程式为:______。
(3)B+D反应时的现象为______。
【答案】CuO Cu HCl+AgNO3==AgCl↓+HNO3 (光亮的红色)物质表面有黑(或银白)色物质析出(生成或出现),溶液由无色变为(浅)蓝色;
【解析】
根据A是黑色氧化物粉末,B是光亮的紫红色物质,且A能生成B,可推知A是氧化铜,B是铜;C、D都是含一种溶质的溶液,且C与氧化铜、D与铜,则C是酸,D是盐,C与D能反应,则C是盐酸,D是硝酸银。
(1)根据分析可知,A是氧化铜,化学式为:CuO;B是铜,化学式为:Cu;
(2)根据分析可知,C是盐酸,D是硝酸银,反应的化学方程式为:HCl+AgNO3==AgCl↓+HNO3;
(3)根据分析可知,B是铜,D是硝酸银,铜与硝酸银发生置换反应,生成硝酸铜和银,故反应时的现象是:(光亮的红色)物质表面有黑(或银白)色物质析出(生成或出现),溶液由无色变为(浅)蓝色。

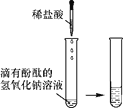
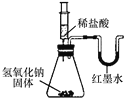
【题目】某化学兴趣小组的同学向氢氧化钠溶液中滴加稀盐酸时,没有看到明显现象。
【提出问题】氢氧化钠与盐酸是否发生了化学反应?
【查阅资料】酸与碱发生中和反应会放出热量。
【实验设计】甲、乙、丙三位同学分别设计了如下实验方案,请你帮他们完成实验报告。
同学 | 实验操作 | 现象 | 结论 |
甲 |
| 溶液由红色变成________ | 氢氧化钠与盐酸发生了化学反应,反应的化学方程式为__________ |
乙 |
| U形玻璃管中________边的红墨水液面下降(所加稀盐酸的体积忽略不计) | 氢氧化钠与盐酸发生了化学反应 |
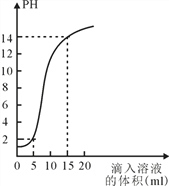
丙 | 用________测定氢氧化钠溶液的pH;向其中滴加足量的稀盐酸后,再测定溶液的pH | 最后溶液的pH________(填“≥7”“≤7”或“不变”) | 氢氧化钠与盐酸发生了化学反应 |
【评价反思】你认为实验设计方案不合理的同学是________,理由是______________________________。