题目内容
【题目】用化学符号填空:
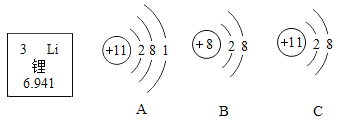
(1)2个氮原子________________。
(2)3个硫酸根离子________________。
(3)构成氯化钠的阳离子________________。
(4)二氧化硫中硫元素的化合价________________。
(5)5个五氧化二磷分子________________。
(6)碳酸钠________________。
(7)氦气________________。
【答案】2N 3SO42- Na+ ![]() 5P2O5 Na2CO3 He
5P2O5 Na2CO3 He
【解析】
(1)元素符号前面的数字表示原子的个数,所以2个氮原子的化学符号为:2N。故填:2N。
(2)离子符号前面的数字表示离子的个数,所以3个硫酸根离子的化学符号为:3SO42-。故填:3SO42-。
(3)氯化钠由钠离子和氯离子构成,一个钠离子带一个单位的正电荷,一个氯离子带一个单位的负电荷,所以构成氯化钠的阳离子的化学符号为:Na+。故填:Na+。
(4)化合价标在元素符号的正上方,二氧化硫的化学式为SO2,氧元素显-2价,根据化合物中各元素化合价的代数和为0,设硫元素化合价为![]() ,
,![]() +(-2)×2=0,解得
+(-2)×2=0,解得![]() = +4。所以二氧化硫中硫元素的化合价用符号表示为:
= +4。所以二氧化硫中硫元素的化合价用符号表示为:![]() 。故填:
。故填:![]() 。
。
(5)化学式的前面加数字表示分子的个数,所以5个五氧化二磷分子用符号表示为:5P2O5。故填:5P2O5。
(6)碳酸钠由钠离子和碳酸根离子构成,钠元素显+1价,碳酸根为-2价,根据化学式的写法:![]() ,因为
,因为![]() ,他们化合价的最小公倍数为2,代入数据得出,
,他们化合价的最小公倍数为2,代入数据得出,![]() =2,
=2,![]() ,所以碳酸钠的化学符号为:Na2CO3。故填:Na2CO3。
,所以碳酸钠的化学符号为:Na2CO3。故填:Na2CO3。
(7)氦气是由原子构成的物质,元素符号He就表示氦气。故填:He。

【题目】甲、乙两种不含结晶水的固体物质,在不同温度下的溶解度(g/100g水)如下:
温度 物质 | 0℃ | 20℃ | 30℃ | 50℃ | 80℃ |
甲 | 13.3 | 31.6 | 36.2 | 85.8 | 169 |
乙 | 35.7 | 36.0 | 36.2 | 36.5 | 37.1 |
根据表中的数据进行判断,下列有关说法正确的是
A.甲的溶解度大于乙的溶解度
B.升高温度可使甲的不饱和溶液转变为饱和溶液
C.使乙物质从它的一定温度下的饱和溶液中析出,一般采用冷却的方法
D.30℃时,甲、乙两种饱和溶液中溶质的质量分数相等
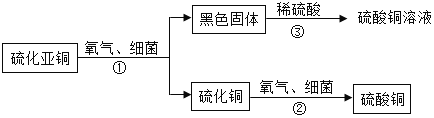
【题目】铜合金是一种常用的金属材料。
(1)赤铜(Cu2O)是我国古代制取黄铜的一种原料。Cu2O的相对分子质量为 ,Cu2O中铜元素和氧元素的质量比是 。
(2)欲测定某铜镁合金的组成(其他元素忽略不计),进行如下实验:取铜镁合金20g放入烧杯,将200g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下表(Mg+H2SO4=MgSO4+H2↑)。
次 数 | 1 | 2 | 3 | 4 |
加入稀硫酸质量/g | 50 | 50 | 50 | 50 |
剩余固体质量/g | 17.6 | m | 13.2 | 13.2 |
请计算:①表中m= g,该铜镁合金样品中铜的质量= 。
②所加稀硫酸中溶质的质量分数。(写出计算过程)
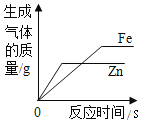
【题目】金属材料在生产、生活中应用广泛。化学实验小组的同学为了解Mn、Fe、Cu三种金属的活动性顺序,进行了如下探究活动。
(作出猜想)
对Mn的活动性顺序提出了三种猜想:
猜想一:Mn>Fe>Cu;
猜想二:Fe>Mn>Cu;
猜想三:____________。
(实验验证)
实验步骤 | 实验现象 | 实验结论 |
①分别向盛有Mn、Fe、Cu三种金属的三支试管中加入同体积同浓度的稀硫酸。 | _______ | 猜想三错误。 |
②向盛有硫酸亚铁溶液的试管中加入金属Mn | 有黑色固体析出。 | 猜想_______正确。 |
已知Mn在生成物中的化合价均为+2价,则步骤②中反应的化学方程式为___________。
(矩展延伸)
若将步骤①和②中反应后的混合物倒入同一烧杯中,搅拌、________(填操作名称)得到固体X和溶液Y。则:
(1)溶液Y中溶质的成分________(填序号)。
A 一定有FeSO4
B 一定有MnSO4
C 可能有H2SO4
D 可能有CuSO4
(2)得到固体X和溶液Y的操作过程中,用到的玻璃仪器有烧杯、玻璃棒和__________,其中玻璃棒的作用是______________________。