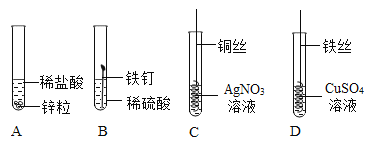
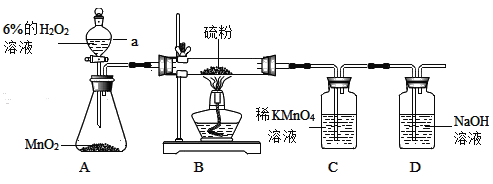
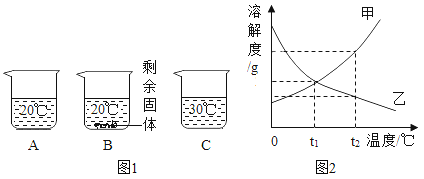
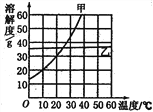
题目内容
【题目】有一包白色粉末,可能由 Na2CO3,BaCl2,NaOH,CuSO4 中的一种和几种组成,为了探究固体的成分,现做如下实验:
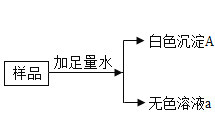

(1)原固体中一定没有_____________;
(2)原固体中一定有____________;
(3)生成气体的化学方程式_____________;
(4)无色溶液a 中一定含有的溶质____________;
(5)下列关于溶液和白色沉淀的设想,合理的是___________。
A除去硝酸钡中的硝酸,加入过量的白色沉淀A
B无色溶液a 能除去氯化钠中少量的盐酸
C鉴别盐酸和碳酸钠:用溶液 b、c、d
【答案】CuSO4 Na2CO3、BaCl2、NaOH BaCO3+2HCl=BaCl2+H2O+CO2↑ NaCl 、NaOH、Na2CO3 A、C
【解析】
白色粉末溶于水后形成无色溶液,说明没有CuSO4;生成的白色沉淀可溶于盐酸且生成气体,推测该白色沉淀A是难溶性碳酸盐,根据题意,应为Na2CO3与BaCl2反应得到的Ba CO3,故无色溶液a中,一定还含有NaCl;溶液a滴加酚酞后变红,说明呈碱性,但并不一定有NaOH的存在,若 Na2CO3过量也可使酚酞变红;又因后续加入过量BaCl2后有白色沉淀,说明红色溶液c中确有Na2CO3,但此时溶液d仍为碱性,故说明一定有NaOH的存在。
(1)白色粉末溶于水后形成无色溶液,说明原固体中一定没有CuSO4;
(2)根据以上分析,可得原固体中一定有Na2CO3、BaCl2、NaOH;
(3)生成气体的反应是白色沉淀Ba CO3与盐酸的反应,故方程式为![]()
(4)根据以上分析,无色溶液a 中一定含有的溶质为NaCl 、NaOH、Na2CO3;
(5)A、往硝酸钡与硝酸的混合溶液中加入过量BaCO3,BaCO3可与硝酸反应生成硝酸钡,二氧化碳和水,既可除杂,又不引入新杂质,合理;
B、无色溶液a含Na2CO3、BaCl2、NaOH,加入NaCl溶液中会引入新杂志,不合理;
C、b中含有氯化钡,能鉴别盐酸和碳酸钠(氯化钡与碳酸钠反应生成白色沉淀);c中含有碳酸钠,能鉴别盐酸和碳酸钠(碳酸钠与盐酸反应生成无色气体);d为含酚酞的氢氧化钠,能鉴别盐酸和碳酸钠(氢氧化钠与盐酸反应后,能使酚酞褪色),合理;
故选A、C