题目内容
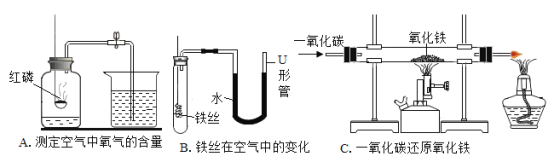
【题目】下图是探究金属化学性质的四个实验,有关叙述不正确的是( )
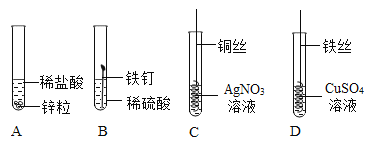
A.由①和②可以得出金属活动性:Zn > Fe
B.由③和④可以得出金属活动性:Fe > Cu > Ag
C.③中铜丝表面有银白色物质析出,溶液变成蓝色
D.②中反应的化学方程式为:Fe +H2SO4=FeSO4 +H2↑
【答案】A
【解析】
A、①中是锌粒与稀盐酸反应,②中是铁片与稀硫酸反应,不能用来探究Zn与Fe的金属活动性强弱,原因是:该实验中酸的种类及金属和酸的接触面积不同,有两个不同的变量,故错误;
B、用于证明铁、铜、银的金属活动性顺序实验是③和④,因为由③知铜能置换出硝酸银中的银,说明活动性铜>银,④中的铁能置换出硫酸铜中的铜,说明活动性铁>铜,所以可得活动性:铁>铜>银,故正确;
C、③中是铜和硝酸银溶液反应生成因和硝酸铜,现象为铜丝表面有银白色物质析出,溶液由无色变成蓝色,故正确;
D、②中是铁和硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe +H2SO4=FeSO4 +H2↑,故正确。
故选A。

 导学全程练创优训练系列答案
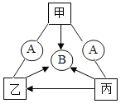
导学全程练创优训练系列答案【题目】右图所示,某河旁甲、乙、丙、丁四座化工厂排放的工业废水中分别含有碳酸钠、氯化铜、氢氧化钠、盐酸中的一种.某同学对①、②、③、④处水质监测时记录了以下现象.根据现象推断,甲、乙、丙、丁四座化工厂排放工业废水的成分,错误的是( )
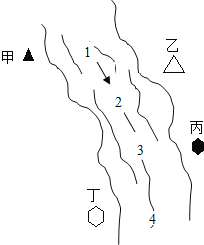
① | ② | ③ | ④ | |
记录现象 | 无色溶液 | 蓝色浑浊 | 浑浊消失 | 产生气泡 |
A.甲:碳酸钠 B.乙:氯化铜 C.丙:盐酸 D.丁:碳酸钠
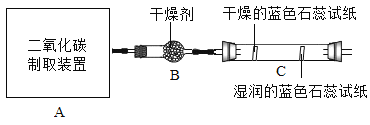
【题目】制造物质、研究物质 小博同学想组装一套能控制反应速率,获得平稳气流的实验室制取二氧化碳装置,则发生装置应选择_________ (填序号)装置,利用装置 E 收集二氧化碳,气体应从_________(填“a”或“b”)端通入;
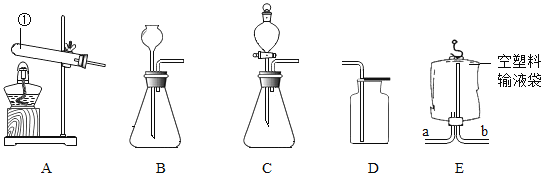
小博同学运用所制得的二氧化碳采用用对比实验方法探究二氧化碳的性质,请根据下列实验要求回答相关问题:
实验一 | 实验二 |
|
|
实验一:振荡 3 个矿泉水塑料瓶,观察到塑料瓶变瘪的程度为 A>B>C, 其中 B 瓶石灰水变浑浊,此反应的化学方程式为_________; 对比_________瓶(选填“A”“B”或“C”)的塑 料瓶变瘪的程度,可证明 CO2 能与 NaOH 发生反应。
实验二:观察到 C 装置中发生的现象是:_________蓝色石蕊试纸_________;此实验可证明__________发生反应。
【题目】在过氧化氢溶液的分解反应中,某化学兴趣小组发现:除了二氧化锰,硫酸铜溶液也能对H2O2的分解起催化作用。对此,他们进行了有关探究。
(提出问题)CuSO4溶液是混合物,是其中哪一种成分起到了催化作用呢?
(查阅资料)①稀硫酸中主要含有H2O、H+、SO42三种微粒。
②CuSO4溶液中主要含有H2O、Cu2+、SO42三种微粒。
(作出猜想)根据以上信息,同学们作出了如下三个猜想:
Ⅰ:SO42催化分解H2O2 Ⅱ:Cu2+催化分解H2O2 Ⅲ:H2O催化分解H2O2
(1)其中,明显不合理的是_______(填序号),理由是_______。
(实验验证)
(2)为了验证自己的猜想,同学们设计了如下两个实验(所取H2O2溶液的浓度相同):
操作 | 现象 | 结论 |
取5 mL H2O2溶液于试管中,滴入少量的稀硫酸,伸入带火星的木条 | _______ | SO42对H2O2的分解不起催化作用 |
_______ | 产生大量气泡,带火星的木条复燃 | _______ |
(实验拓展)
实验一:用图甲装置探究影响H2O2分解速率的因素,得到图乙、图丙所示曲线(在等温条件下,产生氧气体积与装置内压强成正比,反应放热忽略不计)。
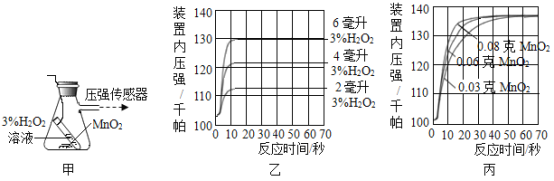
(3)写出图甲中反应的化学方程式_______。
(4)图乙是“0.1 g MnO2与不同体积的3% H2O2溶液混合”的实验结果,从图中可以看出_______。
(5)图丙是用“8 mL浓度为3%的H2O2溶液与不同质量的MnO2混合”时,所得到的曲线,通过该曲线可以得到的结论是_______。
实验二:用图丁装置探究氧气的浓度对燃烧的影响。点燃蜡烛后立即塞紧橡皮塞,待蜡烛熄灭后,将滴管中的水全部滴入瓶中,铝盒中的白磷燃烧。
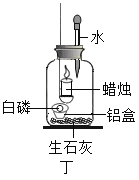
(6)白磷燃烧的主要现象是_______。
(7)由“蜡烛熄灭,白磷燃烧”可得出的结论是_______。
(8)滴入水后白磷燃烧的原因是_______。
【题目】请完成下列实验,回答问题。
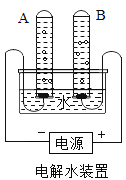
(1)通过水的电解认识水:
①宏观现象:按图所示装置,通电一段时间后,试管A、B中产生气体的体积比约为_______。
②微观该反应中发生分解的微粒名称是___________。
③结论:水由_________组成。
(2)下列依据实验目的所设计的实验操作中,正确的是_______(可能有多个正确选项)
选项 | 实验目的 | 实验操作 |
A | 除去CO2混有HCl气体 | 将气体通过足量NaOH溶液 |
B | 鉴别NH4Cl和KCl两种白色固体肥料 | 加入熟石灰研磨后闻气味 |
C | 检验生石灰中是否有未分解的石灰石 | 滴加稀盐酸观察现象 |
D | 除去二氧化碳中的一氧化碳 | 将气体点燃 |