题目内容
【题目】碱式碳酸镁晶体成分的确定
【查阅资料】(1)Mg(OH)2:白色固体,难溶于水,受热会分解成氧化镁和水;
(2)MgCO3: 白色固体,微溶于水,受热会分解成氧化镁和二氧化碳;
(3)MgCO3的热稳定性比Mg(OH)2的热稳定性更强。
工业生产中得到的碱式碳酸镁晶体是xMgCO3yMg(OH)2zH2O,为精确测量晶体的组成,小组同学取4.66g该晶体,用热分析仪对固体进行热分解(加热使之逐步分解,首先失去结晶水,最后完全反应),测定剩余固体质量与分解温度之间关系。
【数据处理】剩余固体质量与加热时间关系如图所示:
请回答下列问题:
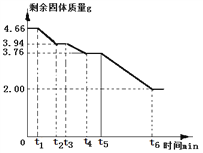
(1)0~t1固体质量没有发生变化的原因可能是_____________。
(2)晶体中结晶水的质量为________g。
(3)t4~t5段固体为_________和MgO(写化学式)。
(4)根据图中数据推算xMgCO3yMg(OH)2zH2O中x:y:z的最简比为___________
【答案】 温度未达到分解所需的温度 0.72 MgCO3 4:1:4
【解析】本题通过探究碱式碳酸镁晶体成分考查了认识图像和化学计算的能力。
(1)0~t1固体质量没有发生变化的原因可能是 温度没有达到晶体分解所需的最低温度;
(2)加热逐步分解,首先失去结晶水,生成水的质量为:4.66g-3.94g=0.72g,晶体中结晶水的质量为 0.72g;
(3)在t4~t5段Mg(OH)2分解已为氧化镁和水,但MgCO3还未分解,故t4~t5段固体为 MgCO3和MgO;
(4)设:碱式碳酸镁的相对分子质量为:84x+58y+18z,
镁元素的质量为:2.00g×![]() ×100%=1.2g,
×100%=1.2g,
碳元素的质量为:1.76g×![]() ×100%=0.48g,
×100%=0.48g,
氢元素的质量为:0.9g×![]() ×100%=0.1g,
×100%=0.1g,
则有:4.66g×![]() ×100%=1.2g,
×100%=1.2g,
4.66g×![]() ×100%=0.48g,
×100%=0.48g,
4.66g×![]() ×100%=0.1g,
×100%=0.1g,
解得:x=4,y=1,z=4,所以xMgCO3yMg(OH)2zH2O中x:y:z的最简比为4:1:4。

【题目】(10分)兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验:
(1)氢氧化钠固体要密封保存,原因有:
① ;② 。
【对固体猜想】
猜想一:全部是NaOH;猜想二:全部是Na2CO3;猜想三:是NaOH和Na2CO3混合物
【实验和推断】(2)为进一步确定成分,进行了以下探究:
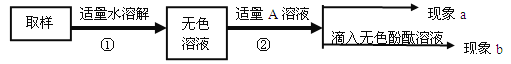
对无色溶液进行以下实验:
实验操作 | 实验现象 | 实验结论 |
第一步: 用试管取约2mL该溶液,滴入适量氢氧化钙溶液,振荡。 | 现象a:白色沉淀 | 化学方程式: ① , 有碳酸钠并全部除尽。 |
第二步: 静置,取上层清液于试管中滴入酚酞溶液,振荡。 | 现象b: ② | 含有NaOH,猜想三成立,是NaOH和Na2CO3混合物 |
③分析:小组中有同学提出质疑,认为以上实验不能证明猜想三成立,理由是:
。
④反思:把第一步中的氢氧化钙溶液换成 溶液,可达到实验目的。
(3)请利用以下提供的试剂,设计实验证明猜想一是正确的,即氢氧化钠没有变质。
提供的试剂有:酚酞溶液、稀盐酸、氢氧化钡溶液、氯化钡溶液
实验操作 | 实验现象 | 实验结论 |