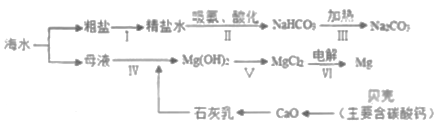
��Ŀ����
����Ŀ����1������200g��������Ϊ5%������������Һ����Ҫ��Ҫˮ______mL������ʱ�õ�����������______���ձ����������ͽ�ͷ�ιܡ���ˮ���ܶȽ��ƿ���1g/cm3��
��2�����������������Һ��ij������Һ��Ӧ����ͼ���������ֻ��������õ�����ҺpH�仯ͼ��
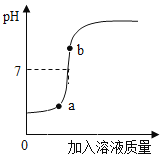
�ٸ���ͼ�����ߣ��жϽ��еIJ�����______������ĸ����
A ��������Һ��εμӵ�����������Һ��
B ������������Һ��εμӵ�������Һ��
�ڴ��۽Ƕȷ������÷�Ӧʵ��Ϊ______��
��b���Ӧ����Һ�е�����Ϊ______��д��ѧʽ����
����80g 5%������������Һ��ǡ���к�50g������Һ���Լ����������Һ��������������_____������д��������̣���
���𰸡�190�� ��Ͳ B �����Ӻ����������ӽ�ϳ�ˮ���� Na2SO4��NaOH 9.8%
��������
��1����������=��Һ���������������������ܼ�����=��Һ����-������������������200g��������Ϊ5%������������Һ����Ҫ�������Ƶ�����Ϊ��200g��5%=10g����Ҫˮ������Ϊ200g-10g=190g����190mL������ʱ�õ�������������Ͳ���ձ����������ͽ�ͷ�ιܣ�
��2��������ҺpH�ı仯��֪����ʼʱ��ҺpHС��7��������Һ��pH����еIJ���Ӧ�ǽ�����������Һ��εμӵ�������Һ�У���ѡB��
�ڴ��۽Ƕ����ı仯��֪���÷�Ӧʵ��Ϊ�����Ӻ����������ӽ�ϳ�ˮ���ӡ�
���������������ᷴӦ���������ƺ�ˮ�������߿�֪��b���Ӧ����Һ��pH����7��˵����������������ǹ����ģ�����Ϊ��Na2SO4��NaOH��
���裺������Һ�����ʵ�����Ϊx��

![]() ��ã�x=4.9g
��ã�x=4.9g
��������Һ��������������=![]() ��
��

 ��У����ϵ�д�
��У����ϵ�д�