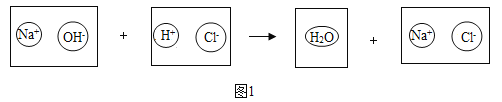
题目内容
【题目】如图是某密闭容器中物质变化过程的微观示意图(已知:●代表氧原子,〇代表硫原子)请回答:
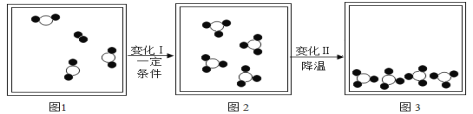
(1)请将图1中缺少的分子模型补画完整_____。变化Ⅱ是_____变化(选填“物理”或“化学”)
(2)写出上图中化学变化的反应方程式_____。
(3)上述微观图中表示混合物的是_____图。
【答案】![]() 物理 2SO2+O2
物理 2SO2+O2![]() 2SO3 1
2SO3 1
【解析】
物理变化中没有新物质生成,化学变化中有新物质生成。
(1)化学反应物前后原子个数不变,所以图1中缺少的分子模型补画完整为:![]() ,物理变化中没有新物质生成,化学变化中有新物质生成,所以变化Ⅱ是物理变化。
,物理变化中没有新物质生成,化学变化中有新物质生成,所以变化Ⅱ是物理变化。
(2)通过分析微观图示可知,该反应是二氧化硫和氧气在一定条件下生成三氧化硫,化学方程式为: 。
。
(3)混合物是由多种分子构成的,所以上述微观图中表示混合物的是1图。

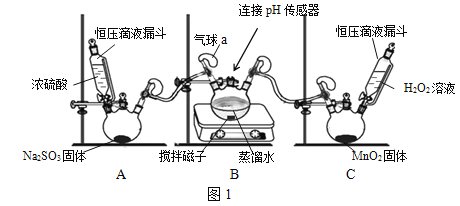
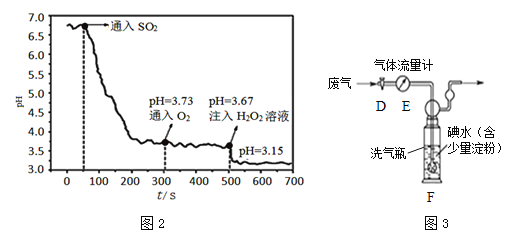
【题目】某实验小组同学对铁粉和氧化铜的混合物与足量的稀硫酸混合后,体系中各反应的先后顺序进行研究。
氧化铜与稀硫酸反应的化学方程式为________________。
(进行实验)以下实验中所用硫酸都是过量的。
实验1:将铁粉和氧化铜的混合物与60mL、10%稀硫酸混合,实验记录如下。
序号 | 铁粉/g | 氧化铜/g | 实验现象 |
1-1 | 0.56 | 1.6 | 立即出现红色固体,无气泡产生,充分反应后溶液呈蓝色 |
1-2 | 1.12 | 1.6 | 立即出现红色固体,无气泡产生,充分反应后溶液呈浅绿色 |
1-3 | 1.68 | 1.6 | 立即出现红色固体,待红色固体不再增加后产生大量气泡,充分反应后溶液呈浅绿色 |
实验2:将1.12g铁粉和1.6g氧化铜的混合物与30mL不同浓度的硫酸混合,实验记录如下。
序号 | 硫酸浓度/% | 实验现象 |
2-1 | 20 | 立即出现红色固体,无气泡产生,充分反应后溶液呈浅绿色 |
2-2 | 30 | 立即出现红色固体,瞬间产生大量气泡,充分反应后溶液呈浅蓝色 |
2-3 | 50 | 立即出现红色固体,瞬间产生大量气泡,反应过程中生成红色固体的同时持续产生细小气泡,充分反应后溶液呈浅蓝色 |
(解释与结论)
(1)浅绿色溶液中一定含有的溶质是H2SO4、____。
(2)实验中出现红色固体反应的化学方程式为_________;
(3)依据实验1推测,在稀硫酸浓度为10%,且硫酸足量的条件下,铁粉、氧化铜与稀硫酸反应的先后顺序为________。
(4)对比分析实验1-2与1-3,解释实验1-2没有产生气泡的原因______。
(5)在实验1-3中,产生氢气的质量最多为____ g。
6)根据实验2判断,下列说法不正确的是____(填字母序号)。
A 硫酸浓度为20%,CuO先于Fe与硫酸反应
B 硫酸浓度为40%,Fe将先于CuO与硫酸反应
C 硫酸浓度为50%,Fe与CuSO4反应的同时也与硫酸反应
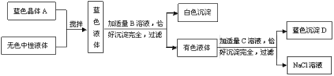
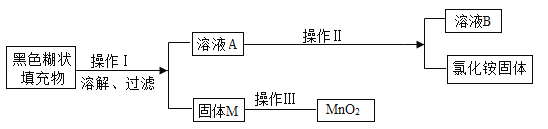
【题目】已知某种干电池的内部黑色糊状填充物含炭黑、二氧化锰、氯化铵和氯化锌。下列是回收利用干电池得到二氧化锰和氯化铵固体的流程:
有关数据见表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 | |
(1)操作I中用到的玻璃仪器有_____、玻璃棒和漏斗;
(2)固体M的成分为_____,操作Ⅲ的简便方法为_____。
(3)操作Ⅱ的过程包括、冷却结晶、过滤、洗涤、干燥。溶液B的溶质为_____;洗涤时最好选用下列物质中的_____作为洗涤液。
A 冰水 B 氯化铵饱和溶液 C 氯化锌饱和溶液 D 氯化钠饱和溶液
(4)施肥时不能将熟石灰与氯化铵混合施用的原因是_____(用化学方程式回答)。