题目内容
【题目】霸树同学对生铁的组成进行研究,称取生铁样品40g,把500g稀硫酸分5次加入样品中,测得实验数据见右表:(杂质不溶于水,也不于稀硫酸反应)
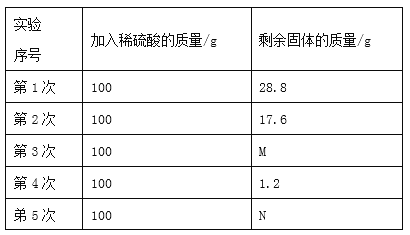
(1)第3次剩余固体的质量M = ____________,第5次剩余固体的质量N_________
(2)该生铁样品中铁的质量分数为______________
(3)计算第一次反应结束后生成氢气的质量________。(写出计算的过程)
【答案】6.4 1.2 97% 0.4g(详见解析过程)
【解析】
根据表中的数据对比分析可知,每100g的硫酸完全反应,反应掉的铁的质量是11.2g,由于在第4次时剩余混合物的质量总共有1.2g,由于17.6g﹣1.2g=16.4g,11.2g<16.4g<11.2g×2,所以第3次硫酸完全反应,剩余固体的质量为17.6﹣11.2g=6.4g;第4次硫酸有剩余,剩余固体不再与硫酸反应,第五次剩余的杂质是1.2g;由此可以求出铁的质量,继而求出铁的质量分数;根据每100g的硫酸完全反应,反应掉的铁的质量是11.2g,可求出第一次反应结束后生成氢气的质量。
(1)每100g的硫酸完全反应,反应掉的铁的质量是11.2g,由于在第4次时剩余混合物的质量总共有1.2g,由于17.6g﹣1.2g=16.4g,11.2g<16.4g<11.2g×2,所以第3次硫酸完全反应,剩余固体的质量为17.6﹣11.2g=6.4g;第4次硫酸有剩余,剩余固体不再与硫酸反应,第五次剩余的杂质是1.2g,所以M=6.4,N=1.2;
(2)该生铁样品中铁的质量分数=![]() =97%;
=97%;
(3)设第一次反应结束后生成氢气的质量x,反应掉的铁的质量为:40g﹣28.8g=11.2g。
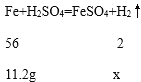
![]() 解得:x=0.4g。
解得:x=0.4g。

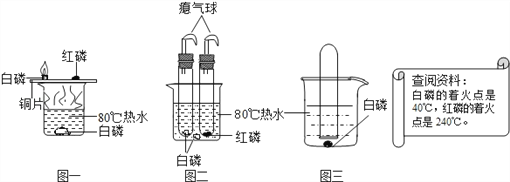
【题目】如图1是“空气中氧气体积分数测定”实验的改进装置。主要操作是:在实际容积为150mL的集气瓶里,先装进50mL的水,再按图1连好仪器,按下热的玻璃棒,白磷立即被点燃。(白磷40℃即燃烧,燃烧产物与红磷相同)
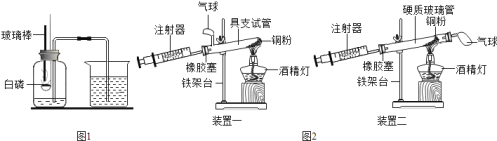
(1)白磷从燃烧到熄灭冷却的过程中,瓶内水面的变化是________,若实验成功,最终集气瓶中水的体积约为______mL。
(2)该实验可推论出氮气的物理性质为________,化学性质为________。
(3)若将白磷换成炭粉,该实验能否获得成功?为什么?_________________。
(4)集气瓶里预先装进的50mL水,在实验过程中起到哪些作用?__________(填写序号)
A.加快集气瓶内气体冷却B.液封导气管末端以防气体逸出C.吸收五氧化二磷
(5)图2是另一实验小组对测定空气中氧气含量实验的两套装置图,请结合图示回答有关问题。(已知铜和氧气在加热的条件下反应生成氧化铜固体)
①根据下表提供的实验数据,完成如表:
硬质玻璃管中 空气的体积 | 反应前注射器中 空气体积 | 反应后注射器中 气体体积 | 实验测得空气中 氧气的体积分数 |
25mL | 15mL | 9mL |
②装置一和装置二中气球的位置不同,_________(填“装置一”或“装置二”)更合理,理由是_______。
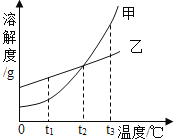
【题目】20℃,将等质量的甲、乙两种固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后观察现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度曲线如图3,请结合图示回答下列问题:
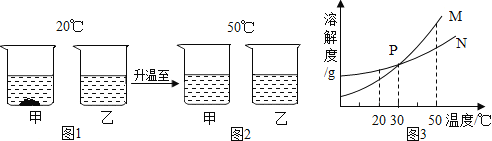
(1)图1中一定为饱和溶液的是__________
(2)图2中一定为不饱和溶液的是_________
(3)图3中表示乙的溶解度曲线的是________,P点表示的意义是___________
(4)某同学利用实验探究NaCl在水中的溶解限度。所得数据记录如表所示:
序号 | 温度 | 水的质量 | NaCl质量 | |
加入 | 未溶 | |||
① | 20℃ | 25g | 9g | 0 |
② | 20℃ | 50g | 20g | 2g |
③ | 20℃ | 100g | 34g | 0 |
④ | 20℃ | 125g | 48g | 3g |
⑤ | 20℃ | 150g | 54g | 0 |
上述实验中,所得溶液为饱和溶液的是___________
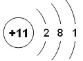
【题目】下图为元素A的原子的结构示意图,请回答:

(1)该原子的原子核中有_____个质子,_______个中子。
(2)下表为元素周期表中部分元素的信息,可知A的元素符号为_________,该元素形成的氧化物的化学式为__________。
第2周期 | 3Li 锂 6.941 | 4Be 铍 9.012 | 5B 硼 10.81 | 6C 碳 12.01 | 7N 氮 14.01 | 8O 氧 16.00 | 9F 氟 19.00 | 10Ne 氖 20.18 |
(3)以碳12原子的质量1.993×10—26kg,一种铁原子的质量为9.288×10—26kg,计算该铁原子的相对原子质量为___________________(只列出计算式)。
【题目】某校兴趣小组的同学从水泥厂拿来一块石灰石样品,技术员告诉他们此样品中含有的杂质难溶于水,不能与盐酸反应。为了测定该样品的纯度,同学取用8.00g这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸100克分5次加入,充分反应后,经过滤、干燥等操作后称量,得到如下数据:
实 验 次 数 | 1 | 2 | 3 | 4 | 5 |
加入稀盐酸的质量/g | 20.0 | 20.0 | 20.0 | 20.0 | 20.0 |
剩余固体的质量/g | 6.00 | m | 2.00 | 1.20 | 1.20 |
试回答下列问题:
(l)表中m的值为_____________。
(2)该石灰石样品的纯度是__________。
(3)反应生成的气体质量是多少克?______________
(4)试计算稀盐酸的质量分数 ____________。