题目内容
 (1)某化学兴趣小组的同学为了体验“工业冶炼金属”的过程.在实验室做了CO还原CuO的实验,他们称得装有CuO粉末的试管重102g,反应完全后,恢复到室温称量,试管和固体残留物共重100.4g,并收集到CO2 4.4g,请你和他们一起计算:
(1)某化学兴趣小组的同学为了体验“工业冶炼金属”的过程.在实验室做了CO还原CuO的实验,他们称得装有CuO粉末的试管重102g,反应完全后,恢复到室温称量,试管和固体残留物共重100.4g,并收集到CO2 4.4g,请你和他们一起计算:①102g-100.4g=1.6g,1.6g表示
②该反应制得铜的质量为
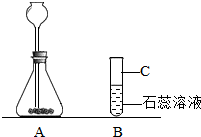
(2)某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到12.5g水垢中,产生CO2气体的情况如下图所示:
①从图中可以看出,12.5g水垢与盐酸反应后生成的二氧化碳最多是
②求水垢中碳酸钙的质量分数.
③要配制10%的这种盐酸100g,至少需要38%的浓盐酸(密度1.19g?cm-3)多少毫升?
分析:(1)①质量102克是指氧化铜和试管的质量之和,质量100.4克是指铜和试管的质量之和,所以差值是氧化铜中氧元素的质量.②写出化学方程式并代入数据计算出铜的质量.
(2)①分析图象可知,当气体的质量达到3.3克之后,气体的质量就不再改变了,说明二氧化碳的最大质量是3.3克.②写出化学方程式并代入数据碳酸钙的质量即可.③稀释溶液前后,溶液中溶质的质量保持不变.
(2)①分析图象可知,当气体的质量达到3.3克之后,气体的质量就不再改变了,说明二氧化碳的最大质量是3.3克.②写出化学方程式并代入数据碳酸钙的质量即可.③稀释溶液前后,溶液中溶质的质量保持不变.
解答:解:(1)①质量102克是指氧化铜和试管的质量之和,质量100.4克是指铜和试管的质量之和,所以差值是氧化铜中氧元素的质量,故答案为:氧化铜中氧元素.
②氧化铜中氧元素的质量=102-100.4=1.6克,设生成铜的质量是X.
CuO+CO
Cu+CO2 △m
80 64 (80-64)
X 1.6
═
得:X=6.4
(2))①分析图象可知,当气体的质量达到3.3克之后,气体的质量就不再改变了,说明二氧化碳的最大质量是3.3克,故答案为:3.3.
②设碳酸钙的质量是Y.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
Y 3.3
═
得:Y=7.5
∴水垢中碳酸钙的质量分数=
×100%═60%.
③10%的盐酸100g中含有氯化氢的质量=100×10%═10克.因为稀释前后溶液的溶质的质量保持不变,所以稀释前38%的浓盐酸中溶质的质量也是10克,则浓盐酸的质量=10÷38%═26.3克.所以浓盐酸的体积=
=22.1cm3.
答:水垢中碳酸钙的质量分数为60%,要配制10%的这种盐酸100g,至少需要38%的浓盐酸的体积是22.1cm3(毫升).
②氧化铜中氧元素的质量=102-100.4=1.6克,设生成铜的质量是X.
CuO+CO
| ||
80 64 (80-64)
X 1.6
| 64 |
| 80-64 |
| X |
| 1.6 |
得:X=6.4
(2))①分析图象可知,当气体的质量达到3.3克之后,气体的质量就不再改变了,说明二氧化碳的最大质量是3.3克,故答案为:3.3.
②设碳酸钙的质量是Y.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
Y 3.3
| 100 |
| 44 |
| Y |
| 3.3 |
得:Y=7.5
∴水垢中碳酸钙的质量分数=
| 7.5 |
| 12.5 |
③10%的盐酸100g中含有氯化氢的质量=100×10%═10克.因为稀释前后溶液的溶质的质量保持不变,所以稀释前38%的浓盐酸中溶质的质量也是10克,则浓盐酸的质量=10÷38%═26.3克.所以浓盐酸的体积=
| 26.3 |
| 1.19 |
答:水垢中碳酸钙的质量分数为60%,要配制10%的这种盐酸100g,至少需要38%的浓盐酸的体积是22.1cm3(毫升).
点评:培养学生的看图的能力,能够判断二氧化碳的最大量,同时注意计算的规范性.

练习册系列答案
相关题目
 23、请你结合下列装置图回答问题:
23、请你结合下列装置图回答问题: