题目内容
【题目】某固体粉末可能含有碳酸钙、氧化铜、氧化铁、氯化钠、木炭粉中的几种,取mg该固体粉末按下列流程进行实验(本流程涉及到的反应均为初中化学常见的反应,且各步均恰好完全反应)。
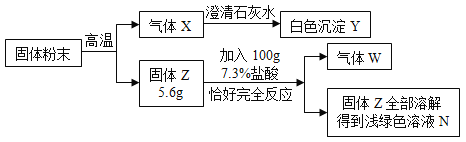
经测定气体W的质量为0.12g,溶液N中加入足量硝酸银溶液充分反应后过滤、洗涤、干燥,得固体30.0g。据此回答下列问题:
(1)原固体粉末中一定有____,一定无____
(2)上述反应过程中一定发生的置换反应方程式(写一个):_______
(3)溶液N中一定含有的溶质_____
【答案】碳粉、氧化铁、碳酸钙、氯化钠 氧化铜 Fe +2HCl=FeCl2+H2↑(其它合理答案均可) FeCl2、CaCl2、NaCl
【解析】
(1)碳酸钙在高温的条件下生成氧化钙和二氧化碳,木炭和氧化铜在高温的条件下生成铜和二氧化碳,木炭和氧化铁高温生成铁和二氧化碳,铜不会与酸反应,铁和盐酸反应生成浅绿色的氯化亚铁和氢气,氧化钙也会与盐酸反应生成氯化钙,
固体粉末高温的条件下生成气体X,X能使澄清的石灰水变浑浊,二氧化碳与氢氧化钙反应生成碳酸钙白色沉淀和水,说明X是二氧化碳,Y是碳酸钙;固体Z5.6g加入100g7.3%的盐酸恰好完全反应,生成气体W,固体Z全部溶解得到浅绿色溶液N,因此Z中有铁,W是氢气,浅绿色溶液N中有氯化亚铁溶液,30g氯化银沉淀中含氯元素的质量为30g×![]() =7.4g,100g73.%的稀盐酸中氯元素的质量为100g×7.3%×
=7.4g,100g73.%的稀盐酸中氯元素的质量为100g×7.3%×![]() =7.1g,故原固体中一定含有氯化钠;因此原固体粉末中一定有碳粉、氧化铁、碳酸钙、氯化钠,一定没有氧化铜。
=7.1g,故原固体中一定含有氯化钠;因此原固体粉末中一定有碳粉、氧化铁、碳酸钙、氯化钠,一定没有氧化铜。
故填:碳粉、氧化铁、碳酸钙、氯化钠;氧化铜。
(2)铁和盐酸反应生成浅绿色的氯化亚铁和氢气,符合置换反应的特征,故填:Fe +2HCl= FeCl2+H2↑。
(3)由(1)分析可知,溶液N中一定含有的溶质FeCl2、CaCl2、NaCl,故填:FeCl2、CaCl2、NaCl。

 阅读快车系列答案
阅读快车系列答案【题目】稀盐酸与氢氧化钠溶液混合后,发现溶液仍为无色。为了证明她们确实发生了化学反应,某学习小组进行如下实验:
|
|
图1 | 图2 |
| |
图3 | |
① 图1中从a→b整个实验过程中观察到的现象是_________________,由此证明上述实验过程确实发生了化学反应。
② 图2表示反应过程中溶液的PH变化情况,c点表示的意义是________________;当溶液的pH=2时,此溶液的溶质有_______________。
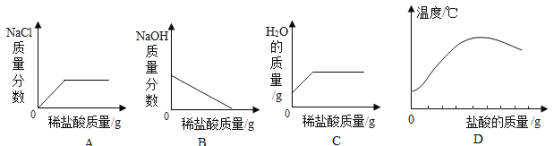
③ 图3表示向一定量的氢氧化钠溶液中逐滴加入稀盐酸至过量,图像中能正确反应对应变化关系的是________________。
④ 为测定氢氧化钠溶液的质量分数,取氢氧化钠溶液50g,用10%的稀盐酸进行测定,当加入稀盐酸为36.5g时恰好完全反应。
I. 稀盐酸中含HCl的物质的量是_____mol;
II. 氢氧化钠溶液的质量分数是___________。(根据化学方程式列式计算)