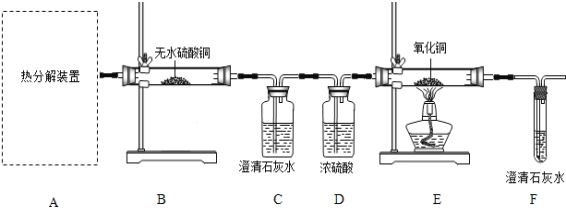
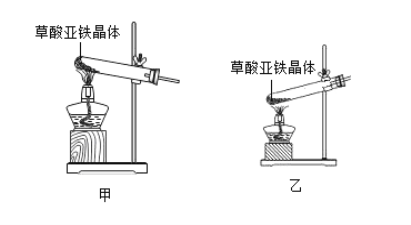
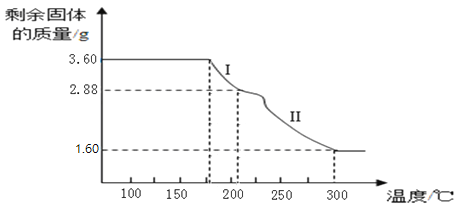
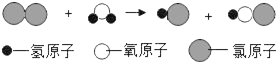
题目内容
【题目】如图是甲、乙两种固体物质的溶解度曲线,下列叙述正确的是( )
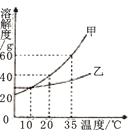
A. 甲溶液中溶质的质量分数比乙大
B. 35℃时100g甲的饱和溶液中含甲的质量为60g
C. 将等质量的甲、乙,分别配成10℃的饱和溶液,所需水的质量:甲>乙
D. 20℃时乙的溶解度小于甲的溶解度
【答案】D
【解析】
A、甲、乙溶液的状态不能确定,所以溶质质量分数也不能确定,故A错误;
B、35℃时甲的溶解度是60g,是指该温度下100g水中溶解60g甲正好饱和,所以100g该温度下的甲溶液中含有的甲的质量小于60g,故B错误;
C、10℃时,甲乙的溶解度相同,将等质量的甲、乙,分别配成10℃的饱和溶液,所需水的质量:甲=乙,故C说错误;
D、由图可知,20℃时乙的溶解度小于甲的溶解度,故D正确;
故选D。

【题目】(5分)KNO3和NaCl在不同温度时的溶解度如下表所示。请回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |||||||||
溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | ||||||||
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | |||||||||
(1)依据上表数据,绘制出KNO3和NaCl的溶解度曲线如图所示:
图中能表示KNO3溶解度曲线的是 (填“A”或“B”)
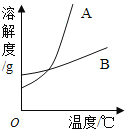
(2)由表中数据分析可知,KNO3和NaCl在某一温度时具有相同的溶解 度,则温度的范围是 ;
(3)某兴趣小组做了一下实验:
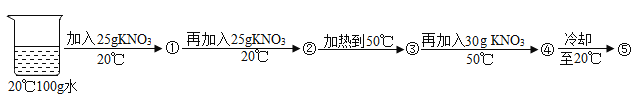
上述实验过程中得到的溶液一定属于不饱和溶液的是 (填数字序号),将⑤继续冷却至10℃,过滤,共可回收得到KNO3固体 g;
(4)硝酸钾中含有少量氯化钠时,可通过 (填“蒸发结晶”或“降温结晶”)的方法提纯。
【题目】(6分)我省两淮地区煤炭资源丰富,瓦斯存在于煤层及周围岩层中,是井下有害气体的总称,主要成分是甲烷。
(1)请你写出甲烷完全燃烧的化学方程式:__________________________________。
(2)煤矿瓦斯爆炸有两个必要条件:
①瓦斯含量在爆炸极限的范围内;②________________________________________。
(3)下表是常见三种气体的爆炸极限,请你据此判断:
最容易发生爆炸的气体是____。
可燃气体 | 爆炸极限(体积分数) |
H2 | 4.0%~74.2% |
CH4 | 5%~15% |
CO | 12.5%~74.2% |
(4)下列图标中,与燃烧和爆炸无关的是
![]()
A B C D
(5)某现代化的矿井采用了“低浓度瓦斯发电技术”,有效解决了矿区及周边地区的照明用电。这种既采煤又发电联合生产的优点是___________________________________。