题目内容
实验课上,同学们用下图所示四种溶液探究与指示剂的作用.实验后进行废液处理,处理过程为:将A和B中液体混合,得到红色溶液E;将C和D中液体混合,得到废液F;将E和F放入烧杯中.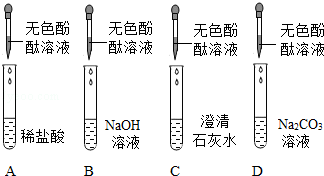
(1)向A中滴加无色酚酞溶液后,溶液颜色为 色.
(2)A和B混合后,溶液中一定没有 .
a.NaCl b.HCl c.NaOH
(3)C和D混合时发生反应的化学方程式为 .
(4)继续对烧杯中的废液成分进行如下探究.
【提出问题】烧杯废液中含有什么物质?
【查阅资料】碳酸钠溶液呈碱性;CaCl2溶液呈中性.
【初步分析】通过分析上述实验现象,烧杯中的废液除酚酞和水外还一定含有 .
【进行实验】请设计实验验证可能含有的物质
| 实验操作 | 现象与结论 |
| | |
(5)为实现绿色排放(溶液呈中性),应对废液再进行的操作是 .
故答案为:(1)无;(2)b;(3)Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(4)CaCO3、NaOH、NaCl;
实验操作现象与结论
①将废液过滤
②取少量滤液于试管中,向其中滴加稀盐酸
③取少量滤液于试管中,向其中加入碳酸钠溶液若有气泡产生,则含碳酸钠
若有沉淀产生,则含氢氧化钙
若两支试管均无现象,两种物质均没有
(5)滴加盐酸至中性(或滴加盐酸至红色消失).
解析试题分析:(1)稀盐酸不能使酚酞变色;(2)将A和B中液体混合,得到红色溶液E,说明溶液显碱性,则一定没有盐酸;(3)碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,方程式是
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;(4)由A和B中液体混合,得到红色溶液E,说明溶液显碱性,则一定含有氢氧化钠和反应生成的氯化钠;碳酸钠和氢氧化钙反应生成氢氧化钠和碳酸钙,则废液中一定含有碳酸钙、氢氧化钠、氯化钠;由于碳酸钠和氢氧化钙是否完全反应无法判断,故废液中可能含有碳酸钠或氢氧化钙;根据碳酸钠可与盐酸反应生成二氧化碳,可将废液过滤,然后取滤液滴加稀盐酸,若有气泡产生,说明含有碳酸钠;另外取滤液滴加碳酸钠溶液,若有沉淀产生,则含氢氧化钙,若两支试管中均无现象,则不含两种物质;(5)由于废液中含有氢氧化钠,所以要实现绿色排放,可向废液中滴加稀盐酸,至溶液中红色恰好消失;
考点:酸、碱性废水的处理.

同学们为了研究氧化铁能否在氯酸钾制取氧气的实验中起催化作用,进行了以下实验:
【资料】①氯酸钾分解反应的化学方程式为 2KClO3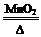 2KCl+3O2↑。
2KCl+3O2↑。
②氯酸钾和氯化钾均能溶于水。
【实验一】氧化铁能否在氯酸钾制取氧气实验中加快反应速率。
| 实验编号 | KClO3/g | 氧化物 | 产生气体的体积(mL) | 耗时(s) |
| 1 | 0.6 | | 67 | 1800 |
| 2 | 0.6 | 0.2g二氧化锰 | 67 | 36.5 |
| 3 | 0.6 | g 氧化铁 | 67 | 89.5 |
(1)实验3中氧化铁的质量为 。
(2)以上实验采用了 的实验方法。
(3)实验一得到的结论是 。
【实验二】为证明氧化铁是该反应的催化剂,同学们又完成了以下的实验:
Ⅰ.在实验3反应后的混合物中加足量的水溶解,过滤得到红色固体,洗涤干燥并用电子天平称量,质量为0.2g。
Ⅱ.将一定量的CO通入滤出的固体,按下图进行实验:

甲同学的实验报告如下:
| 装置 | 实验现象 | 实验分析 |
| A | 红色固体全部变黑 | 生成了铁 |
| B | 石灰水变浑浊 | 产生二氧化碳 |
(4)写出A中玻璃管内发生反应的化学方程式 。
【实验结论】氧化铁能在氯酸钾制取氧气反应中起催化剂。
【实验反思】乙同学查阅资料发现一氧化碳还原氧化铁后剩余固体可能由氧化亚铁、四氧化三铁、铁粉和未反应的氧化铁中的一种或几种组成。
为了研究剩余固体的成分,丙同学查阅了以下资料:
| | 铁粉 | 氧化亚铁 | 氧化铁 | 四氧化三铁 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 磁性 | 有 | 无 | 无 | 有 |
| 与CO反应 | 不反应 | 反应 | 反应 | 反应 |
| 与稀盐酸反应 | 反应 | 生成氯化亚铁和水 | 生成氯化铁和水 | 生成氯化亚铁、氯化铁和水 |
| 与硫酸铜溶液反应 | 反应 | 不反应 | 不反应 | 不反应 |
(5)丙同学认为剩余固体中一定没有氧化铁,原因是____________。
(6)测定剩余固体的组成。
| 步骤 | 实验操作 | 实验现象 | 结论和解释 |
| 1 | 用磁铁吸引剩余固体 | _____________ | 剩余固体中没有氧化亚铁。 |
| 2 | __________________ | ______________ | 剩余固体中只有铁粉。 |
丽丽的爸爸旅游归来,带回一些钟乳硒石块送给了她.丽丽和同学们想验证钟乳石的主要成分是碳酸盐,于是她们将其中一块钟乳石带进实验室进行探究.
(1)请你帮助丽丽完成以下探究方案.
| 实验操作 | 预期的实验现象 | 实验结论 |
| ①取一小块钟乳石于试管中,向试管中加入 ,观察现象. ② ,观察现象. | 有气泡生成 | 钟乳石的主要成分是碳酸盐 |
(2)查阅资料得知钟乳石的主要成分是碳酸钙(假设杂质不溶于水且不与酸发生反应).上述预期的实验现象中有气泡生成的反应的化学方程式为 .
(3)实验后,为了防止废液腐蚀下水管道或对水质产生不良影响,丽丽将所有的废液倒入了一个洁净的烧杯中.她取样测定了废液的酸碱性,你认为她选择的试剂可以是 .测试后得知该废液显酸性,则烧杯中废液的溶质是 .
(4)丽丽向烧杯中的废液里加入过量的 (填序号)能使废液呈中性,过滤后才可安全排放.
①碳酸钙 ②熟石灰 ③生石灰 ④氢氧化钠.
红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如下图所示。同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究。
【提出问题】久置固体的成分是什么?
【查阅资料】铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
【作出猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3,久置固体中可能含有Ca(OH)2的原因是(用化学方程式表示) 。
【实验探究1】
甲同学的方案:
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时试管外壁发烫,试管底部有不容物,溶液变红。 | 固体中一定含有 和氢氧化钙。 |
| (2)另取少量固体放于试管中,滴加足量的 。 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液. | 固体中一定含有 , 一定不含Fe2O3 |
| (3)将步骤(2)中产生的气体通入到澄清的石灰水中 | | 固体中一定含有CaCO3 |
(1)乙同学认为甲同学的实验中不能得出一定含Ca(OH)2的结论,理由是 。
(2)丙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是 。
【实验探究2】
乙、丙同学设计如下实验方案继续验证:
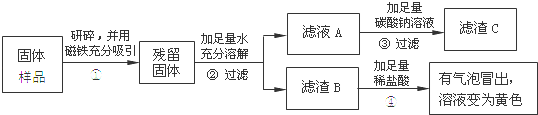
(1)③中反应的化学方程式是 。
(2)乙、丙同学实验中又能得出固体样品中一定还含有 ,仍有一种物质不能确定,该物质是 。
(3)乙、丙同学又经过实验测得上述残留固体中含钙物质的总质量为1.6g,滤渣B中CaCO3的质量为1.0g,滤渣C的质量为1.0g。
【实验结论】综合上述实验及所给数据,久置固体的成分是 。

学校实验室的废液缸中收集了学生在实验室制取CO2后残留的废液.小红同学想探究废液中溶质的成分,请你一同探究并回答下列问题:
【提出问题】废液中的溶质是什么物质?
【做出猜想】小红认为废液中的溶质只有CaCl2.你认为还可能含有的溶质是 .(化学式)
【查阅资料】CaCl2溶质呈中性.
【实验与结论】为了验证小红的结论,小红进行了下面是的实验:
| 实验操作 | 实验现象 | 结论 |
| 取少量废液于试管中,向其中滴加几滴无色酚酞溶液 | 溶液呈 . | 废液中只有 ,自己的猜想正确 |
(1)你认为小红的实验 (填“能”或“不能”)证明她的猜想,理由是 .
(2)如果想要证明我的猜想是正确的,请补充完下面的实验方案
| 实验操作 | 实验现象 |
| ①取少量废液与试管中,向其中加入石蕊溶液 | 废液变为 |
| ②取少量废液与试管中,向其中加入 . | 有气体产生 |
| ③取少量废液与试管中,向其中加入 . |
(3)若实验证明你的猜想是正确的,想要处理废液只得到CaCl2溶液,应向废液中加入过量的 ,反应完成过 .
当前市售珍珠粉的价格从五元到上百元不等,但其外观、手感都没有明显差异.
那么优质珍珠粉和廉价珍珠粉的成分有何不同呢?就此问题,实验小组同学展开探究.
【查找资料】
①优质珍珠粉直接由贝科动物体内珍珠加工而成,含有一定量的氨基酸、碳酸钙等.
②廉价珍珠粉由“贝壳粉”加工而成,贝壳加工过程中会用到氢氧化钠,贝壳的主要成分是碳酸钙.
③珍珠粉中除碳酸钙外,其它成分均不能与盐酸反应生成二氧化碳.
④氨基酸大部分能溶解于水,遇到浓硝酸并加热会呈现黄色或黑色.
⑤碳酸钙与浓硝酸能发生反应,生成二氧化碳.
⑥氯化钙溶液呈中性.
【提出猜想】
优质珍珠粉和廉价珍珠粉的区别可能在于:
①廉价珍珠粉含有 ;
②廉价珍珠粉不含氨基酸;
③碳酸钙含量不同.
【实验探究】
| 实验内容 | 现象 | 结论 |
| (1)分别将少量优质珍珠粉和廉价珍珠粉放入试管中,加少量水,静置一段时间后,滴加 . | 廉价珍珠粉的上层清液变红,优质珍珠粉的溶液没有变色 | 猜想①成立 |
| (2)分别将少量优质珍珠粉和廉价珍珠粉放入试管中,加少量水,加热. | 优质珍珠粉的溶液有黄色出现,局部变黑,廉价珍珠粉的溶液没有明显现象 | 猜想②成立 |
(3)分别将一定质量的优质珍珠粉和廉价珍珠粉放入烧杯中,再逐滴加入14.6%的稀盐酸,边滴加边振荡,直至恰好完全反应.数据记录如下:
| | 优质珍珠粉 | 廉价珍珠粉 |
| 珍珠粉的质量 | 100 g | 100 g |
| 加入盐酸的质量 | 460.0 g | 501.3 g |
| 烧杯中最终物质的总质量 | 520.0 g | 557.7 g |
①处理数据时,小明提出了如下思路:用加入盐酸的质量乘以盐酸的质量分数,求出反应的盐酸中的溶质质量,进而利用化学方程式求出珍珠粉中碳酸钙的质量.你认为小明的思路是否可行,理由是 ②处理数据后,得出结论:廉价珍珠粉中碳酸钙的质量分数为 %(计算结果保留小数点后1位),含量高于优质珍珠粉.
【实验反思】
经过反思,同学们认为仍用上述试剂,只需略调整操作,就可以通过一次珍珠粉的取样完成三个猜想的验证.请写出调整后的作: .

实验室中有一瓶标签受损的无色液体,如图所示.这瓶无色液体是什么呢?实验员老师告诉大家,该液体目前只能是过氧化氢溶液和蒸馏水中的一种.
(1)大家讨论后一致认为不可能是蒸馏水,理由是 。
(2)为确定该液体成分,同学们继续进行了如下实验探究:
| 实验操作 | 实验现象 | 实验结论 |
| | ||
(3)大家认为标签受损的原因可能是 。
(4)通过学习大家知道我国淡水资源缺乏,而海水淡化是未来生活一种重要来源。自然界中的溴元素绝大多数存在于海洋中,其元素符号为Br,根据中文名称 “溴”推测:该元素位于元素周期表 (填“左侧”、“右侧”或“中部”)。
(5) 小明同学从水产市场带回一瓶浑浊的海水,他要模拟自来水厂的净水过程,最终制成蒸馏水.其实验过程如下所示。请你参与实验并回答:

1) 加入絮凝剂A的作用是 ,操作①的名称是 。
2)下列对该操作①过程及结果描述正确的是( )(填编号)
A.此过程发生的是物理变化 B.该操作是利用颗粒大小不同将混合物分离
C.该操作之后得到的“水”仍是咸的 D.该操作之后得到的“水”可以饮用
3)请仔细观察下面三幅图。

在上述实验过程中操作② 应选用三幅图中的装置是 (填序号),
操作③ 应选用的装置是 (填序号)。
李莉同学在化学实验室发现一瓶盛有无色溶液的试剂瓶,其标签严重破损(如图所示).老师告诉他,这瓶试剂可能是硫酸、硫酸钠、硫酸铜、硫酸镁溶液中的一种.[查阅资料]常温下这三种物质的溶解度如下表:
| 物质 | H2SO4 | Na2SO4 | MgSO4 | CuSO4 |
| 溶解度/g | 与水任意比互溶 | 19.0 | 39.0 | 23.1 |
(2)为确定其成分李莉同学对此溶液进行如下实验探究:
[作出假设]该溶液可能是 溶液;
[实验验证]
| 实验方法及步骤 | 可能出现的现象 | 结论或有关化学方程式 |
| | | |