题目内容
某校研究性学习小组对竹子里的气体成分进行了探究,将从竹子里收集的两瓶气体与两瓶空气进行对照实验:
(1)将点燃的木条同时伸入两瓶气体中,发现木条在竹子里气体的旺盛程度比在空气中燃烧的要低.该实验可证明竹子里的气体一定含有 .
(2)将澄清的石灰水同时加入到两瓶气体中,空气不能使澄清石灰水变浑浊,竹子里的气体能使石灰水变浑浊.该实验可证明竹子里的气体一定含有 .
根据以上两个对比实验中的实验现象,从量的多少方面与空气比照,我们可得出的两个结论是:① ;② .
(1)氧气.(2)二氧化碳;氧气比空气中少;二氧化碳比空气中的多.
解析试题分析:(1)点燃的木条在竹子里气体的旺盛程度比在空气中燃烧的要低,但能够燃烧,说明一定有氧气。(2)竹子里的气体能使石灰水变浑浊,说明有二氧化碳气体;木条在竹子里气体的旺盛程度比在空气中燃烧的要低,竹子里气体能马上使石灰水浑浊,则二氧化碳比空气中的多,氧气比空气中少.
考点:常见气体的检验与除杂方法.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案某兴趣小组同学阅读课外资料得知:很多因素都能影响过氧化氢分解速度。于是,
同学们探究影响过氧化氢分解速度的某种因素。
【实验过程】实验数据记录如下:
| | 过氧化氢溶液的质量 | 过氧化氢溶液的浓度 | MnO2的质量 | 测量数据 |
| Ⅰ | 50.0g | 1% | 0.1g | 9 mL |
| Ⅱ | 50.0g | 2% | 0.1g | 16 mL |
| Ⅲ | 50.0g | 4% | 0.1g | 31 mL |
【实验分析】
(1)过氧化氢分解的化学方程式为 。
(2)表格中的“测量数据”的指的是:相同时间内 _。
(3)本实验中,测量O2体积的装置是 (填编号)。

【实验结论】
在相同条件下 。
【交流评价】
(1)甲同学提出在上述实验中测量 同样能得出相同的结论。
(2)乙同学提出用下图装置进行实验,通过比较 也能达到实验目的。

【实验反思】
除了上述因素会影响过氧化氢分解速度外, _(写一种)也会影响过氧化氢分解速度,你的实验方案是 。
某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图所示液,他们对此产生了兴趣。
[提出问题]这瓶溶液究竟是什么?
经过询问实验老师平时的药品保管得知,这瓶无色溶液应该是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中的某一种。为了确定该药品,他们首先进行了理论分析:
(1)小明根据标签上的组成元素认为一定不可能是 。
(2)小英提出,碳酸氢钠、硝酸钠也不可能,你认为她的依据是 。
为了确定该溶液究竟是剩余两种盐的哪一种,他们设计了如下实验。
[设计实验]
| 实验操作 | 实验现象 |
| 取少量样品于试管中,慢慢滴加BaCl2溶液,静置一段时间,倾去上层清液,向沉淀中继续滴加稀盐酸 | 先出现白色沉淀,后产生大量气泡 |
[实验结论]该瓶无色溶液是 。
生成白色沉淀过程的化学方程式是 。
[实验反思]小强认为上述设计实验还可简化,仍能达到目的。小强的实验操作是 。经查阅资料得知上述五种盐里碳酸钠、碳酸氢钠的溶液呈碱性,其余三种盐的溶液呈中性,请你再设计一种实验方法,确定该溶液究竟是哪种盐,简述实验操作和现象 。
在学习碳酸钠的性质的课堂上,老师在碳酸钠溶液中加入一定量的澄清石灰水产生白色沉淀,在滤出沉淀后的滤液,引导同学们对滤液中溶质的成分进行探究.同学们通过讨论认为溶质是NaOH、Na2CO3、Ca(OH)2中的一种或两种,其可能情况有三种:①NaOH;②NaOH和Na2CO3;③ 。
小伟同学设计了下列实验方案,请你帮助完成.
| 实 验 步 骤 | 可能出现的实验现象 | 实验结论 |
| (1)取少量滤液于试管中,加入碳酸钠溶液 | 产生 | 假设③成立 |
| (2)取少量滤液于试管中,加入足量稀盐酸 | 放出无色气体 | 假设 成立 |
| (3)取少量滤液于试管中,加入碳酸钠溶液或足量稀盐酸 | 没有明显现象 | 假设 成立 |
实验课上,同学们用下图所示四种溶液探究与指示剂的作用.实验后进行废液处理,处理过程为:将A和B中液体混合,得到红色溶液E;将C和D中液体混合,得到废液F;将E和F放入烧杯中.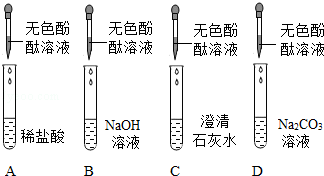
(1)向A中滴加无色酚酞溶液后,溶液颜色为 色.
(2)A和B混合后,溶液中一定没有 .
a.NaCl b.HCl c.NaOH
(3)C和D混合时发生反应的化学方程式为 .
(4)继续对烧杯中的废液成分进行如下探究.
【提出问题】烧杯废液中含有什么物质?
【查阅资料】碳酸钠溶液呈碱性;CaCl2溶液呈中性.
【初步分析】通过分析上述实验现象,烧杯中的废液除酚酞和水外还一定含有 .
【进行实验】请设计实验验证可能含有的物质
| 实验操作 | 现象与结论 |
| | |
(5)为实现绿色排放(溶液呈中性),应对废液再进行的操作是 .
某化学兴趣小组的同学按照课本上的实验装置做“测定空气中氧气的体积分数”实验(如图所示),但测出的氧气的体积分数明显小于1/5。请你参与探究:
(1)提出问题:造成误差的原因是什么?如何改进课本上的实验装置?
(2)查阅资料:红磷、白磷的一些性质如下表:
| | 颜色、状态 | 熔点/℃ | 着火点/℃ | 密度/(g/cm3) |
| 红磷 | 暗红色固体 | 590 | 240 | 2.34 |
| 白磷 | 白色或黄色固体 | 44.1 | 40 | 1.82 |
(3)猜想与假设:
①甲同学:可能是导管内原含有空气,后来留有吸入的水,影响实验的准确性。
②乙同学:可能是瓶内残留气体中还有氧气。
③你还能作出的猜想是 。
(4)交流与讨论:
①丙同学认为用木炭代替红磷,就可以消除误差,你认为他的猜想 ,(填“合理”或“不合理”)理由是 。
②他们对课本上的实验装置进行了图2所示的改进(其他仪器忽略)。
a.甲同学提出应把红磷换为白磷,理由是 _______________。
b.通过粗铜丝来点燃玻璃管内的白磷,这利用了金属的 性。
c.与课本上的实验装置相比较,该装置的一个优点是_________________________________.
(5)探究与反思:
①为了验证乙同学的猜想,将铜粉放在残余气体中加热,观察到铜粉变黑色,证明乙同学的猜想 (填“合理”或“不合理”)
②大家用改进的实验装置(如图所示)进行实验,待玻璃管冷却、管内白色的烟幕消失时,左玻璃管内的液面上升了1格,得到了较准确的结果,但又意外发现左玻璃管内壁上端附着黄色固体。左玻璃管上端的黄色固体的主要成分可能是 。

在学习了金属活动性顺序的知识后,小华想在实验室里通过实验验证一下Zn、Fe、Cu三种金属的活动性,设计了如下实验:
①取相同形状的铁片、锌片、铜片,分别用砂纸打磨至光亮,放入试管中。
②分别加入5毫升20%的稀硫酸,观察现象并记录到下面的表格中。
| 试管编号 | 1 | 2 | 3 |
| 反 应 物 | Zn片+稀H2SO4 | Fe片+稀H2SO4 | Cu片+稀H2SO4 |
| 反应现象 | 气泡多、大、上升快 | 气泡细小,上升慢 | 没有气泡 |
(1)根据小华的实验设计可知,他是通过 来判断金属活动性的。
(2)在实验过程中,细心的小华还发现了二个有趣现象①试管发烫,②反应的速度随时间而变化,他粗略的用图像画了下来(如下图)。反应速度为什么会这样变化呢?科学老师给了他一个启示:化学反应的速度跟反应温度、反应物的溶质质量分数有关。经过思考小华给出了一个合理的解释 。

(3)对于验证三种金属的活动性,小明提出了一个 更简单的方案:把锌片、铜片分别放入 溶液,通过观察反应的现象就可以了。

