题目内容
【题目】碘化钾(KI)是白色固体,保存不当会被氧化为单质碘( I2)而泛黄变质。化学兴趣小组查得以下资料:
Ⅰ.对于碘化钾变质的原理,有两种不同的反应:
甲:4 KI+O2 +2CO2= 2K2CO3 +2I2 乙:4KI+ O2 +2H2O=4KOH +2I2
Ⅱ. KOH与NaOH两者的化学性质相似。为探究碘化钾变质原理的合理性,进行以下实验。
【实验过程】
[实验1]取适量碘化钾固体暴露于空气中一段时间,观察到固体泛黄。往泛黄的固体中加入足量稀硫酸,产生无色无味的气体,通入澄清石灰水中,澄清石灰水变浑浊。
(1)石灰水变浑浊的原因是_______________(用化学方程式表示)。
(2)化学兴趣小组的同学认为:据此现象,还不能得出“反应甲是造成碘化钾变质的原因”的结论。理由是_____________________。
[实验2]按甲图所示装置进行实验,数日后,观察到碘化钾固体无泛黄现象。
(3)据此现象,可得出的结论是_________________。
[实验3]按乙图所示装置进行实验,数日后,观察到碘化钾固体无泛黄现象。
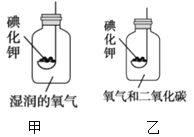
查阅文献获知,常温下某些气体和固体反应须在潮湿环境中进行。化学兴趣小组据此改进实验,很快观察到固体泛黄的现象。
(4)简述化学兴趣小组改进实验的具体措施:________________。
【实验结论】
(5)根据上述实验,化学兴趣小组得出结论:碘化钾固体泛黄变质是碘化钾与________共同作用的结果。
【答案】 CO2+Ca(OH)2=CaCO3↓+H2O 不能判断碳酸钾是由按反应甲生成的,还是按反应乙生成的氢氧化钾吸收空气中的CO2而产生的 反应乙不是造成碘化钾泛黄的原因 向乙装置中再加少量的水 氧气、二氧化碳和水
【解析】本题通过碘化钾变质的原理的探究考查了碱的化学性质和控制变量法的应用。首先分析题中提供的信息和考查的问题,然后结合学过的知识和题中的提示进行分析。
(1)二氧化碳能和石灰水反应生成不溶于水的碳酸钙和水,化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
(2)碘化钾变质可以生成碳酸钾,碘化钾变质生成的氢氧化钾,吸收二氧化碳也会生成碳酸钾,加入稀硫酸,将产生气体通入澄清石灰水变浑浊的现象,不能判断碳酸钾是由按反应甲生成的,还是按反应乙生成的氢氧化钾吸收空气中的CO2而产生的。不能得出“反应甲是造成碘化钾变质的原因”的结论;
(3)根据方程式甲:4KI+O2 +2CO2= 2K2CO3 +2I2和乙:4KI+ O2 +2H2O=4KOH +2I2可知,按如图所示装置进行实验,数日后,观察到碘化钾固体无泛黄现象,可得出的结论是:反应乙不是造成碘化钾泛黄的原因;
(4)根据“常温下某些气体和固体反应须在潮湿环境中进行”可知,向乙装置中再加少量的水,很快观察到固体泛黄的现象。
(5)根据上述实验,化学兴趣小组得出结论:碘化钾固体泛黄变质是碘化钾与氧气、二氧化碳和水共同作用的结果。