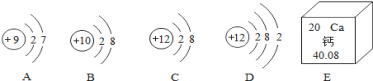题目内容
【题目】氧气和二氧化碳是两种重要的气体,请根据学过的知识作答:
①工业上用分离液态空气的方法制取氧气,主要是利用了氧气和氮气的_______不同,二氧化碳通常不可燃,也不助燃,密度大于空气,因此通常用它来______________。
②根据所给的仪器回答问题。
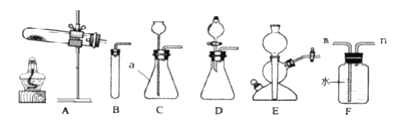
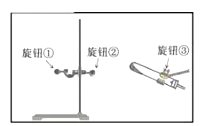
Ⅰ.写出仪器a名称,a______。
Ⅱ.某同学用A装置制取氧气时发现试管位置太高,不能用外焰加热,该同学应调节如图中的旋钮____(填“①”或“②”或“③”)。利用改正后的A装置制取氧气,反应的化学方程式:____________________,若用装置F收集并粗略测出收集![]() 体积,氧气从____(填m或n)处进入。
体积,氧气从____(填m或n)处进入。
Ⅲ.B、C、D、E均可作为实验室制备![]() 的发生装置,与C相比,B装置的不足之处是__________________。使用E装置时,装置E的优点是______________。要使反应停止,应进行的操作是_______________。
的发生装置,与C相比,B装置的不足之处是__________________。使用E装置时,装置E的优点是______________。要使反应停止,应进行的操作是_______________。
Ⅳ.用石灰石和足量的稀盐酸充分反应,制得二氧化碳为![]() 。试计算:参加反应的碳酸钙的质量为_________克?(根据化学方程式列式计算)
。试计算:参加反应的碳酸钙的质量为_________克?(根据化学方程式列式计算)
【答案】沸点 灭火 锥形瓶 ② ![]() n 不方便添加液体 随时控制反应的发生与停止 关闭活塞 20g
n 不方便添加液体 随时控制反应的发生与停止 关闭活塞 20g
【解析】
①工业上用分离液态空气的方法制取氧气,主要是利用了氧气和氮气的沸点不同,二氧化碳通常不可燃,也不助燃,密度大于空气,所以通常用它来灭火;
②I、通过分析题中所指仪器的名称和作用可知,a是锥形瓶;
II、用A装置制取氧气时发现试管位置太高,不能用外焰加热,该同学应调节图中的旋钮②,利用改正后的A装置制取氧气,氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,化学方程式:![]() ,氧气密度比水小,不易溶于水,所以若用装置F收集并粗略测出收集
,氧气密度比水小,不易溶于水,所以若用装置F收集并粗略测出收集![]() 体积,氧气从n处进入;
体积,氧气从n处进入;
III、B、C、D、E均可作为实验室制备![]() 的发生装置,与C相比,B装置的不足之处是:不能随时添加液体。使用E装置时,装置E的优点是:随开随用,随关随停,随时控制反应的发生与停止,要使反应停止,应进行的操作是:关闭活塞;
的发生装置,与C相比,B装置的不足之处是:不能随时添加液体。使用E装置时,装置E的优点是:随开随用,随关随停,随时控制反应的发生与停止,要使反应停止,应进行的操作是:关闭活塞;
IV、设参加反应的碳酸钙的物质的量为x,则
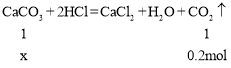
![]()
所以参加反应的碳酸钙的质量为0.2mol×100g/mol=20g。

 阅读快车系列答案
阅读快车系列答案【题目】某小组同学在实验室进行实验,请你参与。
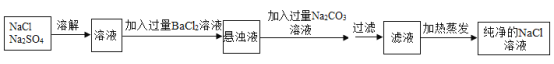
(1)同学们先取少量在空气中久置的氢氧化钠固体样品加水配制成溶液,另取2mL该溶液于小烧杯中,然后滴加几滴酚酞溶液,振荡,此时观察到的实验现象为:_____________________。接着向烧杯中逐滴加入稀盐酸并用玻璃棒搅拌,溶液的颜色改变,同时观察到有气泡产生。结论:氢氧化钠变质。请化学方程式解释氢氧化钠变质的原因:_____________________。
(2)针对氢氧化钠变质的程度做了进一步探究。
(作出猜想)猜想一:样品部分变质,成分为NaOH、Na2CO3;
猜想二:样品完全变质,成分为_______________。
(查阅资料)①BaCl2溶液显中性,BaCO3难溶于水。②向碳酸钠溶液中逐滴加入稀盐酸的反应是分步反应,会发生生成碳酸氢钠和氯化钠的反应。
(实验探究)为验证猜想,同学们设计了两个方案,并进行实验。
①定性方案设计,请你将该实验设计补充完整。
实验内容 | 实验现象 | 得出结论 |
取少量样品溶液,加入足量BaCl2溶液,静置,向上层清液中滴加几滴无色酚酞溶液 | ______________ | 猜想一正确 |
②定量方案设计 先准确称取 11.95g 变质的NaOH样品放入锥形瓶中,用电子秤称得锥形瓶及样品的总质量为46.95g,再把 150.00 g7.3 %稀盐酸平均分成 6等份,每份25.00g依次在充分摇动锥形瓶时,加入样品中,每次充分反应后用电子秤称得锥形瓶及所盛物质的质量,实验数据记录如下:
加入盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | 第六次 |
锥形瓶及所盛物质总质量/g | 71.95 | 96.95 | 120.85 | 144.75 | 168.65 | 193.65 |
(实验结论)请根据上述实验数据,计算样品中氢氧化钠的质量分数为______(精确到0.1%),猜想一正确。
(反思交流)
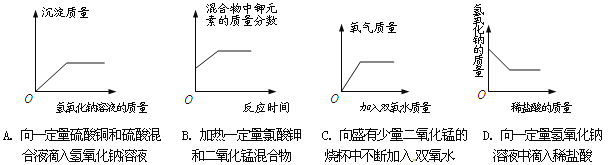
①在如图的直角坐标系中画出产生气体的质量与所加稀盐酸质量的关系曲线______。
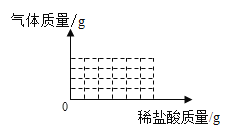
②请判断第二次加入盐酸过程中发生反应的化学方程式_________________,原因______________________。
【题目】水是生命的源泉,也是不可缺少的资源.
①某矿泉水的主要矿物质成分及含量如下表:
成分 | Ca | K | Zn | F |
含量(mg/L) | 20 | 3 | 0.06 | 0.02 |
这里Ca、K、Zn、F是指_____(填“元素、原子、单质”).
②家用净水机中用活性炭的作用是_____.
③能确认水是由氧元素和氢元素组成的实验是_____(填字母).
Ⅰ.氢气在氧气中燃烧生成水Ⅱ.水的蒸发Ⅲ.水的电解Ⅳ.水的净化
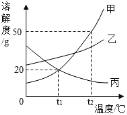
④如图所示是a、b、c三种物质的溶解度曲线,根据图示回答:
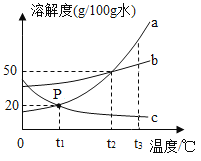
Ⅰ.P点的含义是____________________________________________.
Ⅱ.t2℃时,将30ga物质加入到50g水中不断搅拌,溶液质量为______g.
Ⅲ.要把t1℃时C物质的不饱和溶液变为饱和溶液,有关说法正确的是______.
A 可以采取升高温度的方法 B 溶剂的质量一定不变
C 溶质的质量分数一定变大 D 溶质的质量可能不变
Ⅳ.若a溶液中含有少量b,则提纯a的方法是___________________________.
Ⅴ.将t3℃时将等质量的a、b、c三种物质饱和溶液降温到t1℃时,三种溶液的溶剂质量大小关系是___________________.