题目内容
【题目】回答下列与金属有关的问题。
(1)在生铁和四氧化三铁中,属于合金的是_____;
(2)在炼铁反应Fe2O3+3CO![]() 2Fe+3CO2中,发生氧化反应的物质是_____;
2Fe+3CO2中,发生氧化反应的物质是_____;
(3)仅利用铝丝、铜丝、硝酸银溶液来验证铝、铜、银的金属活动性顺序时,应先把足量的____丝放入少量的硝酸银溶液中,待充分反应后再放入另一种金属丝。
【答案】生铁 CO 铜
【解析】
(1)生铁和钢都是铁的合金,四氧化三铁是氧化物,不属于合金;故填:生铁;
(2)该反应中发生氧化反应的物质是得氧的物质,为一氧化碳,故填:CO;
(3)因为活动性:铝>铜>银,所以用铝丝、铜丝、硝酸银溶液来验证铝、铜、银的金属活动性顺序时,应先把足量的铜丝放入少量的硝酸银溶液中,待充分反应后再将铝丝放入得到的硝酸铜溶液中观察现象;故填:铜。

【题目】小组同学在探究金属与酸反应时,将铝片、锌片打磨后,分别投入盛有等体积、等浓度稀盐酸的试管中,观察到铝与稀盐酸反应较锌与稀盐酸反应快。
【提出问题】金属与盐酸反应快慢,除与金属的种类有关外,还受哪些因素的影响呢?
【猜想与假设】a.可能与盐酸的浓度有关;b. 可能与反应时的温度有关。
【设计并实验】小明利用如图甲所示装置,用不同质量分数的盐酸和相同形状的锌片进行如下实验。
实验编号 | 盐酸的质量分数(均取20 mL) | 温度/℃ | 记录的数据 |
① | 5% | 30 | |
② | 10% | 20 | |
③ | 5% | 20 | |
④ | 10% | 30 |
【讨论】(1)写出锌与稀盐酸反应的化学方程式__________。
(2)实验时,需将金属片打磨,其目的是__________。
(3)实验前小明先将分液漏斗的活塞关闭,再将注射器活塞往右拉,松手后,观察到注射器活塞回到原处。小明进行该操作的目的是______________。
【分析数据、得出结论】
(4)实验中记录的数据可能是_____________。
(5)对比实验________可知温度对金属与酸反应的速率的影响。
(6)实验表明,四次实验时,反应的速率由快到慢依次为④、②、①、③。根据记录的数据分析,如果盐酸质量分数为10%,温度为25℃,则所记录数据应该介于哪两次实验所记录的数据之间?________________________。
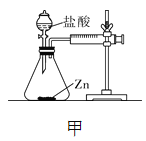
【拓展】进行锌与稀盐酸反应时,试管外壁发烫,并测得实验过程中生成氢气的体积随时间变化的曲线如图乙所示,根据曲线归纳锌与稀盐酸反应速率的变化规律______________,结合上述探究解释曲线变化的原因 ________________________________。
【题目】学习了元素的相关知识后相信同学们都有所收获,请根据所学的知识和提供的信息回答下列问题:

元素周期表的一部分
1 H | 2 He | ||||||
3 Li | 4 Be | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne |
(1)图甲表示元素周期表中的一种元素,该元素属于 元素;(填“金属”或“非金属”),该元素原子中中子数为 ,图甲中表示的元素形成的离子结构示意图是 ;
(2)图乙表示的原子形成的离子符号为 ,该离子与 的核外电子排布相同。