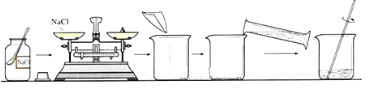
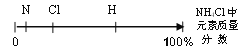
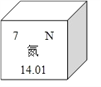
题目内容
【题目】将40g稀盐酸逐滴加入到20g溶质质量分数为4%的氢氧化钠溶液中,边滴加边搅拌。随着稀盐酸的滴加,溶液的pH变化如图一所示,溶液的温度变化如图二所示(不考虑反应过程中热量损失)。试回答:
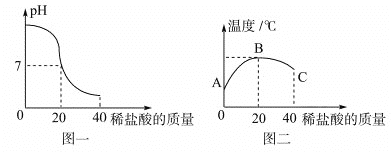
(1)图二从A到B过程中,溶液的pH逐渐__________(填“增大”或“减小”)。
(2)图二表示酸碱恰好完全反应的点是___________。
(3) 向图二C点处的溶液中滴加紫色石蕊试液,溶液显_______ 色。
(4)计算稀盐酸中溶质的质量分数为__________。(写出计算过程)
【答案】 减小 B 红 3.65%
【解析】(1)根据溶液的pH的变化分析回答;(2)根据中和反应是放热反应分析回答;(3)结合图一、图二分析解答;(4)根据氢氧化钠的质量计算稀盐酸中溶质的质量分数。(1)由图象可知,图二从A到B过程中,溶液的pH逐渐减小;(2)中和反应是放热反应,当酸碱恰好完全反应时放出的热量最多,溶液的温度最高,所以图二表示酸碱恰好完全反应的点是B;(3)结合图一、图二可知,C点时溶液的pH<7,故向图二C点处的溶液中滴加紫色石蕊试液,溶液显红色;(4)由图象可知,恰好酸碱中和时消耗稀盐酸的质量是20g,设20g的稀盐酸中溶质的质量为x。
HCl+NaOH═NaCl+H2O
36.540
x20g×4%![]()
x=0.73g
稀盐酸中溶质的质量分数是![]() ×100%=3.65%
×100%=3.65%
答:稀盐酸中溶质的质量分数为3.65%

【题目】K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如下。下列说法错误的是( )
温度/℃ | 20 | 30 | 50 | 60 | 80 | |
溶解度/g | K2CO3 | 110 | 114 | 121 | 126 | 139 |
KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 | |

A. t℃在60℃到80℃之间,且甲表示KNO3的溶解度曲线
B. t℃时,甲、乙两种溶液的溶质质量分数不一定相等
C. 把60℃时的105g KNO3饱和液降温至20℃,能析出晶体78.4g
D. 两种饱和液从80℃降温到20℃,析出晶体的质量(不含结晶水)无法比较
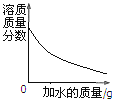
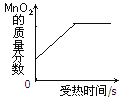
【题目】下列四个坐标图分别表示四个实验过程中某些量的变化,其中不正确的是( )
|
|
|
|
过氧化氢 溶液分解 | B.向盐酸和氯化钙的混合溶液中滴加 碳酸钠溶液 | C.在一定温度下,向有氯化钠固体的氯化钠溶液中加入水搅拌 | D.给氯酸钾和二氧化锰的混合物加热 |
A. A B. B C. C D. D