题目内容
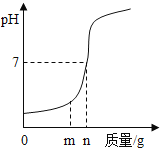
【题目】如图是 a、b、c 三种物质的溶解度曲线,a 与c 的溶解度曲线相交于 P 点。据图回答:

(1)P 点的含义是____________。
(2)t2℃时 30ga 物质加入到 50g 水中不断搅拌,能形成 80g 溶液吗?_______________(填“能”或“不能”)。
(3)t2℃时,a、b、c 三种物质的溶解度按由小到大的顺序排列的是_________(填物质序号)。
(4)将 t2℃时的 a、b、c 三种物质的饱和溶液降温到 t1℃时,溶液中溶质质量分数最小的是___________(填写物质序号)。
(5)若b 中含有少量a,则提纯 b 采用的方法是______________。
(6)将t2℃时等质量的 a、b 两物质的饱和溶液分别降温至 t1℃,对所得溶液的叙述正确的是____________(填字母序号)。
A溶剂质量:a>b B析出晶体质量:a>b C溶质质量分数:a<b
【答案】t1℃时,a、c的溶解度相等 不能 c< b< a c 蒸发结晶 BC
【解析】
(1)a 与c 的溶解度曲线相交于 P 点,P 点的含义是:t1℃时,a、c的溶解度相等。故填:t1℃时,a、c的溶解度相等。
(2)t2℃时 a物质的溶解度为50g,100g水中最多溶解50ga物质,50g水中最多溶解25ga物质,将30ga 物质加入到 50g 水中不断搅拌,能形成 75g 溶液,不能形成80g溶液。故填:不能。
(3)t2℃时,a、b、c 三种物质的溶解度,直接看图中t2℃时的纵坐标(表示溶解度),按由小到大的顺序排列的是c< b< a。
(4)将 t2℃时的 a、b、c 三种物质的饱和溶液降温到 t1℃时,a、b的溶解度随温度降低而减小,所以降温到 t1℃时溶液的质量分数就是该温度下饱和溶液的质量分数,(饱和溶液中溶解度越大,溶质的质量分数越大),此时b的溶解度大于a的溶解度,故质量分数b>a;c的溶解度随温度降低而增大,溶质,溶剂质量都不变,故降温后c的质量分数就是降温前t2℃时饱和溶液的质量分数,又因为饱和溶液中溶解度越大,溶质的质量分数越大,t2℃时c饱和溶液的溶解度(纵坐标)小于t1℃时a溶液的溶解度(纵坐标),降温后c的质量分数小于a的质量分数,所以a、b、c 三种物质的饱和溶液降温到 t1℃时,溶质的质量分数c< a < b,即溶液中溶质质量分数最小的是c。故填c。
(5)b的溶解度受温度影响较小,a的溶解度受温度影响较大,若b 中含有少量a,则提纯 b 采用的方法是蒸发结晶。故填:蒸发结晶。
(6)将t2℃时等质量的 a、b 两物质的饱和溶液分别降温至 t1℃:
A. 降温对溶剂质量没有影响,只是溶质会析出,降温前t2℃时溶解度a>b,等质量的 a、b 两物质的饱和溶液中溶剂质量:a<b,故降温后溶剂质量也是a<b。故A不符合题意;
B. 降温前后a的溶解度变化较b大,等质量的 a、b 两物质的饱和溶液从t2℃降到t1℃,析出晶体质量:a>b 。故B符合题意;
C. a、b的溶解度随温度降低而减小,所以降温到 t1℃时溶液的质量分数就是该温度下饱和溶液的质量分数,饱和溶液中溶解度越大,溶质的质量分数越大,此时b的溶解度大于a的溶解度,故质量分数:a<b。故C符合题意。
故选:BC。

【题目】为了对氯化钾样品(含少量的KNO3)进行分析,甲、乙、丙三位同学分别进行实验,他们的实验数据如下表,清仔细观察和分析数据,回答下列问题:
甲 | 乙 | 丙 | |
所取固体样品的质量/g | 20 | 10 | 10 |
加入AgNO3溶液的质最/g | 100 | 100 | 150 |
反应后所得沉淀质量/g | 14.35 | 14.35 | 14.35 |
(1)三位同学中,哪一位同学所用的氯化钾与硝酸银刚好相互完全反应____ (填写编号)。
(2)样品中氯化钾的质量分数是多少? ______
(3)三位同学分别把反应后的溶液过滤(操作中的损失可忽略不计),哪一位同学所得的滤液是只含有一种溶质的溶液________?此溶液中溶质的质量分数是多少? ______