题目内容
【题目】20℃时,向下列3只盛有100g水的烧杯中,分别加入40g三种固体,充分溶解。
温度/℃ | NaCl | KNO3 | NaNO3 |
20 | 36.0g | 31.6g | 88g |
60 | 37.3g | 110g | 125g |

将三份溶液升温至60℃,下列说法正确的是()
A.①②③的溶质质量分数都发生改变
B.①②③都变成不饱和溶液
C.②中溶质和溶剂的质量比为2:5
D.溶液质量②<③
【答案】C
【解析】
A、将三份溶液升温至60℃,①溶液中剩余的NaCl会溶解部分,溶液中溶质的质量增加,溶质的质量分数变大;②溶液中剩余的KNO3全部溶解,溶液中溶质的质量增加,溶质的质量分数变大;③溶液中,溶质的质量不变,溶质的质量分数不变,故选项A不正确;
B、①溶液中还有NaCl没有溶解,仍然是饱和溶液,②③溶液都变成不饱和溶液,故选项B不正确;
C、60℃,KNO3的溶解度是110g,加入的40gKNO3全部溶解,溶液中溶质和溶剂的质量比=40g:100g=2:5,故选项C正确;
D、60℃,40gKNO3加入100g水中,全部溶解,溶液的质量是140g;60℃,40gNaNO3加入100g水中,全部溶解,溶液的质量是140g ,所得溶液质量相等,故选项D不正确。
故选:C。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
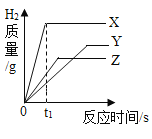
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】在一密闭容器中,有X、Y、Z、Q四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表:
物质 | X | Y | Z | Q |
反应前质量/g | 8 | 20 | 2 | 5 |
反应后的质量/g | 待测 | 10 | 8 | 13 |
对该反应,下列说法中正确的是( )
A.反应后X的质量为4 gB.该反应为分解反应
C.参加反应的X、Y的质量比是2∶5D.Y、Q的相对分子质量比一定为5∶4
【题目】下表是NaCl和Na2CO3在不同温度下的溶解度,下列说法中不正确的是( )
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解度/g | NaCl | 35.0 | 35.5 | 36.0 | 36.5 | 37.0 |
Na2CO3 | 6.0 | 10.0 | 18.0 | 36.5 | 50.0 | |
A. 两种物质溶解度相等的温度在30℃
B. 生活在盐碱湖附近的人们习惯“夏天晒盐、冬天捞碱”
C. 40℃时,5gNaCl中加10g水可得溶质质量分数为26.3%的溶液
D. 40℃时,9g Na2CO3中加20g水,充分溶解后再降温到10℃,析出固体的质量为7g
【题目】取暖贴是冬季常用的一种防寒用品,可快速缓解并消除各种畏寒疾病引起的疼痛,图示为某品牌取暖贴,小明剪开内包装袋,倒出其中的粉末,发现呈黑色,该黑色固体粉末的主要成分是什么呢?

(作出猜想)该黑色粉末可能含有炭粉、铁粉、氧化铜、二氧化锰中的一种或几种。
(进行实验)为了确定该黑色粉末的成分,小组同学又进行了如下实验:
实验操作 | 实验现象 | 实验结论 |
①取少量黑色粉末于试管中并加入过量的稀硫酸 | 固体部分溶解,有气泡产生,溶液变为浅绿色 | 该黑色粉末肯定含有_______,肯定不含__________ |
②取实验①的残渣灼烧,将内壁涂有澄清石灰石灰水的小烧杯罩在上方 | 澄清石灰水变浑浊 | 该黑色粉末肯定含______ |
(反思评价)(1)实验①中发生反应的化学方程式为__________。
(2)小明查阅资料知道,取暖贴发热是因为铁粉在氯化钠和水的作用下能加快氧化,放出热量。该过程是将化学能转化为__________能。
(拓展创新)小明利用该原理,设计如图所示实验装置,探究碳粉对铁锈蚀速率的影响进行实验,观察到量筒内水沿导管慢慢进入广口瓶(净容积为146mL),当温度恢复至室温且量筒内水面高度不变时读数,数据记录如下:
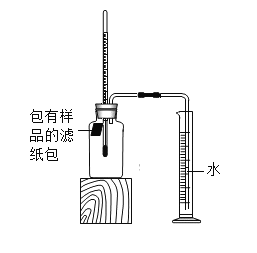
序号 | 样品 | 量筒起始读数/mL | 量筒最终读数/mL | 所需时间/mL |
① | 1g铁粉、0.2g碳、10滴水和少量NaCl | 100 | 70 | 约70 |
② | _________ | / | / | / |