题目内容
(8分)
(1)下列关于氢氧化钡性质的描述中,属于碱的共同性质的是
(2) 氢氧化钡与其它不同的碱表现出一些共同的性质,这是因为碱溶液中都含有 (用符号表示)。
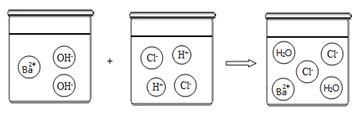
(3)根据下图可以看出酸与碱发生中和反应的微观本质是 。
(4)请写出氢氧化钡与下列物质反应的化学方程式:
①与CO2反应: ;
②与CuCl2溶液反应: 。
(1)下列关于氢氧化钡性质的描述中,属于碱的共同性质的是
| A.能使紫色石蕊溶液变蓝色 | B.能与盐酸反应生成水 |
| C.能与Na2SO4溶液反应生成BaSO4沉淀 | D.能与CO2反应生成水 |
(3)根据下图可以看出酸与碱发生中和反应的微观本质是 。

(4)请写出氢氧化钡与下列物质反应的化学方程式:
①与CO2反应: ;
②与CuCl2溶液反应: 。
(1)B (2)Ba2+ (3)OH-+H+="=" H2O
(4)①CO2 +Ba(OH)2 ==BaCO3↓+ H20 ②Ba(OH)2+CuCl2==BaCl2+Cu(OH)2↓
(4)①CO2 +Ba(OH)2 ==BaCO3↓+ H20 ②Ba(OH)2+CuCl2==BaCl2+Cu(OH)2↓
试题分析:(1)A、碱溶液能使紫色石蕊溶液变蓝色,如果是不溶性碱,就不能在溶液中电离出OH-,也就不能能使紫色石蕊溶液变蓝色,错误,B、能与盐酸反应生成水,正确,C、能与Na2SO4溶液反应生成BaSO4沉淀,只是Ba(OH)2的化学性质,错误,D、可溶性碱能与CO2反应生成水,而不溶性碱不能,错误,故选B
(2)碱表现出一些共同的性质:是因为碱溶液中都含有OH-,氢氧化钡与其它不同的碱表现出一些共同的性质,这是因为碱溶液中都含有Ba2+
(3)酸与碱发生中和反应的微观本质是:OH-+H+="=" H2O
(4)①氢氧化钡与CO2反应化学方程式:CO2 +Ba(OH)2 ==BaCO3↓+ H20
②氢氧化钡与CuCl2溶液反应化学方程式:Ba(OH)2+CuCl2==BaCl2+Cu(OH)2↓

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目





