题目内容
(8分)某校兴趣小组同学准备进行常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中(如下图),有一装溶液的试剂瓶未盖瓶盖且标签破损,于是决定对这瓶溶液进行实验探究:

提出问题】这瓶溶液是什么溶液?
【获得信息】酸、碱、盐的性质实验中用到含有钠元素的物质是氯化钠、氢氧化钠、碳酸钠
【提出猜想】这瓶溶液是:猜想一:氯化钠溶液;猜想二:氢氧化钠溶液;猜想三:碳酸钠溶液。
【实验推断】
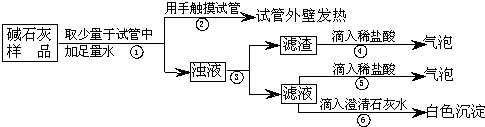
(1)小丽取样滴加无酚酞试液,溶液呈红色,得出结论:该溶液不可能是 溶液,
(2)小刚另取样滴加稀盐酸有 产生,反应的化学方程式为 ,
小刚得出结论:该溶液是碳酸钠溶液。
(3)小青认为小刚的结论不完全正确, 小组同学讨论后一致认为还需要进行如下实验:
【继续探究】另取样加入过量的CaCl2溶液,观察到有 产生,静置后,取上层清液,滴入酚酞试液,溶液呈红色。
【实验结论】这瓶溶液是 。
【探究启示】实验取完药品后应 。
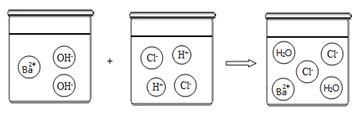
【拓展迁移】若该溶液与盐酸发生中和反应,恰好完全反应的微观过程如图所示,反应的实质表达式为:H+ + OH- = H2O,则反应后溶液中存在的阴、阳离子是 (填符号)。


提出问题】这瓶溶液是什么溶液?
【获得信息】酸、碱、盐的性质实验中用到含有钠元素的物质是氯化钠、氢氧化钠、碳酸钠
【提出猜想】这瓶溶液是:猜想一:氯化钠溶液;猜想二:氢氧化钠溶液;猜想三:碳酸钠溶液。
【实验推断】
(1)小丽取样滴加无酚酞试液,溶液呈红色,得出结论:该溶液不可能是 溶液,
(2)小刚另取样滴加稀盐酸有 产生,反应的化学方程式为 ,
小刚得出结论:该溶液是碳酸钠溶液。
(3)小青认为小刚的结论不完全正确, 小组同学讨论后一致认为还需要进行如下实验:
【继续探究】另取样加入过量的CaCl2溶液,观察到有 产生,静置后,取上层清液,滴入酚酞试液,溶液呈红色。
【实验结论】这瓶溶液是 。
【探究启示】实验取完药品后应 。
【拓展迁移】若该溶液与盐酸发生中和反应,恰好完全反应的微观过程如图所示,反应的实质表达式为:H+ + OH- = H2O,则反应后溶液中存在的阴、阳离子是 (填符号)。

(1)氯化钠 (2)气泡 Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(3)白色沉淀 NaOH溶液(填变质的NaOH溶液也可) 立即盖好瓶盖,重新贴上标签 Cl-、Na+
(3)白色沉淀 NaOH溶液(填变质的NaOH溶液也可) 立即盖好瓶盖,重新贴上标签 Cl-、Na+
试题分析:【实验推断】(1)碳酸钠、氢氧化钠溶液均呈碱性,都能使酚酞变红,而氯化钠溶液呈中性,不能使酚酞变红,该溶液不可能是氯化钠的溶液;(2)溶液中含有碳酸钠时会和盐酸反应生成二氧化碳气体,其方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O;(3)因氢氧化钠易变质与空气中的二氧化碳反应会生成碳酸钠,所以猜想该溶液可能是碳酸钠的溶液,或是变质的氢氧化钠溶液;【继续探究】检验溶液是否是氢氧化钠溶液,就需要排除碳酸钠对氢氧化钠的鉴定干扰,加入足量的氯化钙溶液(合理即可)可使碳酸根全部转化成白色沉淀,而后对溶液用酚酞试液进行检验,只要溶液此时变红,则可证明氢氧化钠的存在;【实验结论】由实验探究可知这瓶溶液是氢氧化钠溶液(或变质的氢氧化钠溶液);【探究启示】从探究可知氢氧化钠很易与空气中的二氧化碳反应生成碳酸钠,所以实验完毕时应尽快盖好瓶塞,以免使药品变质;【拓展迁移】通过观察反应的微观过程图,可以看出反应后溶液的阴、阳离子为Cl-、Na+;

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目