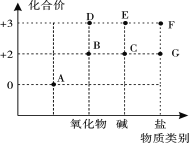
题目内容
【题目】回答下列与金属有关的问题。
(1)工业上常以赤铁矿为原料炼铁,请写出该反应的化学方程式________________________;
(2)据统计每年因腐蚀而报废的金属设备和材料相当于年产量的20% ~40%,铁制品锈蚀的过程实际上是铁与空气中的___________和水蒸气等发生反应的过程;
(3)在空气中无法燃烧的铁丝,可以在氧气中燃烧,其反应现象为_______________________;
(4)古代“银针验毒”的原理是4Ag + 2H2S + O2 = 2X + 2H2O,根据化学反应前后原子数目和种类不变,推出X的化学式为_____________。
【答案】Fe2O3+ 3CO![]() 2Fe + 3CO2 氧气或O2 剧烈燃烧,火星四射,生成黑色固体,同时放出大量的热 Ag2S
2Fe + 3CO2 氧气或O2 剧烈燃烧,火星四射,生成黑色固体,同时放出大量的热 Ag2S
【解析】
本题考查范围较广,涉及金属的冶炼、金属的锈蚀、铁在氧气中燃烧实验现象、化学方程式的书写。
(1)赤铁矿主要成分是氧化铁,因此赤铁矿为原料炼铁的化学方程式即为氧化铁与一氧化碳反应方程式:Fe2O3+ 3CO![]() 2Fe + 3CO2。
2Fe + 3CO2。
(2)铁制品锈蚀的过程实际上是铁与空气中氧气(O2)和水蒸气等发生反应的过程。
(3)铁丝在氧气中燃烧的实验现象是:剧烈燃烧,火星四射,生成黑色固体,同时放出大量的热。
(4)根据化学方程式可知4Ag + 2H2S + O2= 2X + 2H2O,反应前银原子、氢原子、硫原子、氧原子的数目分别为4、4、2、2,反应后银原子、氢原子、硫原子、氧原子的数目分别为0、4、0、2,根据化学反应前后原子数目和种类不变,X分子应含有两个Ag,一个S,故X的化学式为:Ag2S。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】“石头纸”就是用磨成粉末的石头为主要原料做成的。这种纸防水坚固不易燃烧,最重要的是不用砍树造纸,非常环保。日程表、便签纸等东西都是以碳酸钙为主要原料的低碳“石头纸”。为测定其中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品。分别在5只烧杯中进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与水和盐酸反应):
烧杯① | 烧杯② | 烧杯③ | 烧杯④ | 烧杯⑤ | |
加入样品的质量/g | 10 | 10 | 10 | 10 | 10 |
加入稀盐酸的质量/g | 10 | 20 | 30 | 40 | 50 |
充分反应后生成气体的质量/g | 0.88 | 1.76 | X | 3.52 | 3.52 |
(1)表中X的值为________;
(2)在烧杯_______中碳酸钙完全反应;
(3)求样品中碳酸钙的质量分数_____。