��Ŀ����
����Ŀ����Ԫ�������ڣ�ij��ѧ��ȤС��̽������ˮ���ռ�����ʱ����ѡ���ü��ȸ�����ؽ������ʵ�飮
��1��д�����ȸ�����ط�Ӧ�Ļ�ѧ����ʽ ��
��2������ˮ���ռ�����ʱҪ�ȵ�����������������ð�����ſ�ʼ�ռ���ԭ���� ��
��3����������⡿����������������ð������ʱ�ų��������Ƚϴ���������ʵ�����
����Ʋ�ʵ�顿���ø�����ؼ��ȷֽ�����������ⶨ��ͬʱ�̴��Թ��ų���������������Ũ�ȣ�
ʱ�� | ����Ũ�ȱ仯�ص� | ����Ũ�ȱ仯��Χ | ����ʱ�� | �������� |
�� | ������ | 21.2%������ | 1��11s | �������������� |
11��16s | ���������ȡ����� | |||
�� | �������� | 28.8%��66.7% | 16��34s | |
�� | ��ů | 66.7%��86.3% | 34��80s | |
�� | �����ȶ� | 86.3%��88.7% | 80s��135 |
�ڼ���ҩƷ�ĵڢ�ʱ�κ��ڣ�11��16s���������Ѿ������������ҿ���ð������ʱ�ų�������������Ũ�����ֻ��%���ң�
��4������������������ð��ʱ��ʾ�ų��������Ѿ��Ƚϴ�������˵������������������������ģ�
��5�����������ϡ����ڳ�����������ʵ����ԣ�����Ũ��ֻ��ﵽһ������ֵ��������ʵ��Ҫ�ɣ�
��ʵ��̽����
��ȡһ������ƿ��ʹƿ������ռ����ƿ40%��ˮ�����µ�Ϊ���������ò���Ƭ��ס����������װ��ˮ��ˮ���У�
������ˮ���ռ�������С�ĵذ�ƿ�ڵ�ˮ�����ò���Ƭ��סƿ�ڣ�ȡ�������źã�
�۴�����ľ�����뼯��ƿ�У�������ľ����ȼ��
����˼�뽻����
ͨ��ʵ��̽��������ʹ������ľ����ȼ�����������һ������һ�������Ǵ�����
��6������ƿ���������������=�ռ�������ռ�ݻ����������+ƿ�п���ռ�ݻ������������%��
��7�������ϣ�����ʵ�顰ʹ�����ǵ�ľ����ȼ�����������������%������������һλС��������ȤС�����ò�ͬʱ���ռ���������������1ƿԤ��������ˮ���������飬������Ӧ��ʵ����������
ʱ��1������10s�� | ʱ��2������15s�� | ʱ��3������35s�� | |
������ľ�� | ��ȼ | ��ȼ | ��ȼ |
ľ̿ȼ�� | ľ̿��� | ȼ�գ���� | ����ȼ�գ��� |
����ȼ�� | ȼ�ո�������� | ȼ�ո������� | ȼ�ո������� |
��˿ȼ�� | ��˿�۳ɺ�ɫС���л�������⣩ | ȼ�գ������Ľ�����������ɫ�������� | ȼ�գ������Ľ����н϶��ɫ�������� |
��8��ʵ���������ˮ���ռ�����ʱ�����˵�ʱ���� �� �����ϱ���ʵ�����������ó����۵�ԭ�� ��
���𰸡�
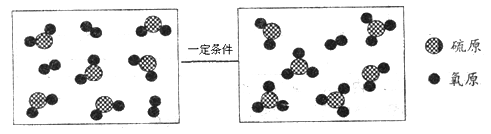
��1��2KMnO4 ![]() K2MnO4+MnO2+O2��
K2MnO4+MnO2+O2��
��2��һ��ʼ�������к��н϶�Ŀ���
��3��28.7
��4��������
��5����һ��
��6��21
��7��52.6
��8�����ȵ�35s����,ʱ��3�ռ����������е��ĸ�ʵ��Ч����������
����������1���ø����������������Ҫ���ȣ�����������ȷֽ���������غͶ������̺���������Ӧ�Ļ�ѧ����ʽΪ��2KMnO4 ![]() K2MnO4+MnO2+O2����
K2MnO4+MnO2+O2����
��2�������ݾ��������ķų�ʱ�����ռ���������Ϊһ��ʼ�������к��н϶�Ŀ�����
��3���ڼ���ҩƷ�ĵڢ�ʱ�κ��ڣ�11��16s���������Ѿ������������ҿ���ð������ʱ�ų�������������Ũ�����ֻ��28.7%���ң�
��4�����ݱ������ݿ��Է��֣���������������ð��ʱ���ų����������DZȽϴ�����
��5��ͨ��ʵ��̽��������ʹ������ľ����ȼ��������һ���Ǵ�����
��6������ƿ���������������=�ռ�������ռ�ݻ����������+ƿ�п���ռ�ݻ������������21%��
��7������ƿ���������������=�ռ�������ռ�ݻ����������+ƿ�п���ռ�ݻ������������21%������ƿ���ռ�������ռ�ݻ����������Ϊ40%����ʱ������ռ60%�����Կ���������������Ϊ��60%��21%=12.6%�����Դ�ʱƿ�ڹ��������ķ���Ϊ��12.6%+40%=52.6%��
��8��ʵ���������ˮ���ռ�����ʱ�����˵�ʱ���Ǽ��ȵ�35s���ң������ϱ���ʵ����������ó����۵�ԭ��ʱ��3�ռ����������е��ĸ�ʵ��Ч���������룮
���Դ��ǣ���1��2KMnO4 ![]() K2MnO4+MnO2+O2������2��һ��ʼ�������к��н϶�Ŀ�������3��28.7����4������������5����һ������6��21��7��52.6��8�����ȵ�35s���ң�ʱ��3�ռ����������е��ĸ�ʵ��Ч���������룮
K2MnO4+MnO2+O2������2��һ��ʼ�������к��н϶�Ŀ�������3��28.7����4������������5����һ������6��21��7��52.6��8�����ȵ�35s���ң�ʱ��3�ռ����������е��ĸ�ʵ��Ч���������룮
�����㾫����������Ŀ����֪������������д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ�����֪ʶ���Եõ�����Ĵ𰸣���Ҫ����ע�⣺a����ƽ b������ c�����ţ�

 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д� ���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�
���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�