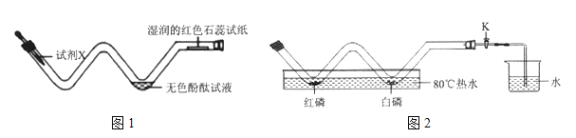
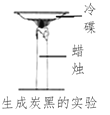
题目内容
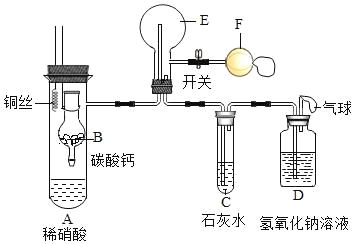
【题目】有一包固体,可能合有NaCl、NaOH、Na2CO3、Na2SO4、MgCl2中的一种或几种,为确定其组成,取少量固体加足量水溶解得到无色溶液M,进行如图实验:
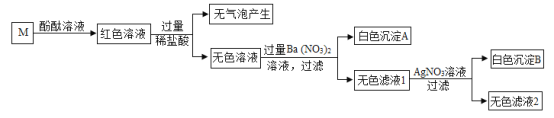
(1)写出生成白色沉淀A的化学方程式_____;
(2)原固体中一定含有的物质是_____;
(3)写出无色滤液2中一定含有的阳离子的符号_____;
(4)实验方案不能完全确定混合物的组成,只需改进实验流程中的一处就能达到实验目的,改进的简要方法是_____。
【答案】Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3 NaOH、Na2SO4 Na+、H+、Ba2+ 方法一:将上述实验中的稀盐酸改成稀硝酸;
方法二:取原固体少量加足量水溶解,先加过量的稀硝酸,再加过量的Ba(NO3)2溶液,过滤,取滤液滴加适量的AgNO3溶液,如果产生白色沉淀,证明有NaCl。
【解析】
氢氧化钠、碳酸钠在溶液中显碱性,能使酚酞变红色,碳酸钠和酸反应会生成二氧化碳,氢氧化钠和氯化镁会生成氢氧化镁沉淀,硫酸根离子和钡离子会生成硫酸钡沉淀,氯离子和银离子会生成氯化银沉淀。所以
M中滴加酚酞,溶液变红色,M中可能含有氢氧化钠、碳酸钠;滴加稀盐酸,无气泡产生,说明M中不含碳酸钠,含有氢氧化钠;氢氧化钠和氯化镁不能共存,所以M中不含氯化镁;无色溶液中滴加硝酸钡会生成白色沉淀A,所以M中含有硫酸钠,白色沉淀A是硫酸钡;无色滤液I滴加硝酸银会生成白色沉淀B,说明无色滤液I中含有氯离子,所以B是氯化银沉淀。由此可知:
(1)白色沉淀A是:BaSO4,生成白色沉淀A的化学方程式Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3;
(2)通过推导可知,原固体中一定含有的物质是:NaOH、Na2SO4;
(3)由于加入的稀盐酸和硝酸钡是过量的,所以无色滤液2中一定含有的阳离子是:Na+、H+、Ba2+;
(4)通过上述实验可知还有一种物质不能确定是否存在,盐酸会引入氯离子,对氯化钠的检验造成干扰,所以为进一步确定,应采用的方法是:方法一:将上述实验中的稀盐酸改成稀硝酸;
方法二:取原固体少量加足量水溶解,先加过量的稀硝酸,再加过量的Ba(NO3)2溶液,过滤,取滤液滴加适量的AgNO3溶液,如果产生白色沉淀,证明有NaCl。

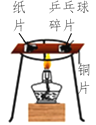
【题目】下列“课外实验”得出的结论错误的是
选项 | A | B | C | D |
课外 实验 |
|
|
|
|
实验 结论 | 说明蜡烛 含有炭黑 | 说明有些花的色素 可做酸碱指示剂 | 不同物质着火点不同 | 说明同种溶质在不同种 溶剂里溶解性不同 |
A. AB. BC. CD. D