题目内容
【题目】质量守恒定律对科学发展具有重大意义。
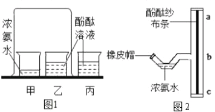
Ⅰ.用如图所示的 3 个实验装置进行验证质量守恒定律的实验,其中不能达到实验目的是_____(填序号),其原因是_____。

Ⅱ.A 图是测定红磷燃烧前后质量的变化情况,用来验证质量守恒的实验,试回答:
(1)红磷燃烧的化学方程式是_____。
(2)在这个实验中气球的作用是_____。
(3)将橡皮塞上的玻璃管放在酒精灯上灼烧到红热后,迅速用橡皮塞将锥形瓶塞紧,并将红磷引燃,这里要“迅速用橡皮塞将锥形瓶塞紧”的原因是_____。
Ⅲ.C 中反应的化学方程式是_____。
Ⅳ.在不同时刻,某反应中的甲、乙、丙、丁四种物质的质量如下表。已知甲的相对分子质量为丁的 2 倍,则下列说法不正确的_____。
甲的质量/g | 乙的质量/g | 丙的质量/g | 丁的质量/g | |
反应前 | 64 | 10 | 1 | 16 |
t 时刻 | 32 | a | ||
反应后 | 0 | 42 | b | 48 |
A.该反应的基本类型是分解反应 B.a 等于 32
C.丙可能是催化剂 D.该反应方程式中甲与丁的化学计量数之比为 2:1
【答案】B 碳酸钠与盐酸反应生成气体,装置未密闭,气体逸出导致反应前后天平不能保持平衡 4P+5O2![]() 2P2O5 密封容器,缓冲气压 防止红磷燃烧时气体受热膨胀,从锥形瓶中逸出,导致反应前后天平不平衡 Fe+CuSO4=FeSO4+Cu BD
2P2O5 密封容器,缓冲气压 防止红磷燃烧时气体受热膨胀,从锥形瓶中逸出,导致反应前后天平不平衡 Fe+CuSO4=FeSO4+Cu BD
【解析】
Ⅰ.用图A中的装置进行验证质量守恒定律,能达到目的,原因在于装置是密封的;图B不能达到目的,因为生成的二氧化碳气体散逸到空气中去了;图C也能达到目的,因为生成物和反应物中都没有气体产生;
Ⅱ.(1)白磷燃烧生成五氧化二磷,该反应的化学方程式是:4P+5O2![]() 2P2O5;
2P2O5;
(2)白磷燃烧过程中看到的现象是产生大量的白烟,放出热量,其中小气球能容纳一部分空气,所以的作用是缓冲气压;
(3)“迅速用橡皮塞将锥形瓶塞紧”的原因是防止生成物(白烟)逸出,产生测量误差;
Ⅲ.铁和硫酸铜反应生成铜和硫酸亚铁,其C中反应的化学方程式为:Fe+CuSO4═FeSO4+Cu;
Ⅳ.由表中数据分析可知,反应前后甲的质量增加了64g-0g=64g,故甲是反应物,参加反应的甲的质量为64g;同理可以确定乙是反应物,生成的乙的质量为42g-10g=32g;丁是生成物,生成的丁的质量为48g-16g=32g,由质量守恒定律,丙的质量不变,可能作该反应的催化剂,也可能没有参加反应;A、该反应的反应物为甲,生成物是乙和丁,符合“一变多”的特征,属于分解反应,故选项说法正确;B、参加反应的甲和生成的乙的质量比为64g:32g=2:1,则当参加反应的甲的质量为32g时,生成的乙的质量为16g,则a等于10g+16g=26g,故选项说法错误;C、丙的质量不变,丙可能作该反应的催化剂,也可能没有参加反应,故选项说法正确;D、甲、丁的质量比64g:32g=2:1,已知甲的相对分子质量为丁的2倍,则该反应方程式中甲与丁的化学计量数之比为1:1,故选项说法错误。

 阅读快车系列答案
阅读快车系列答案