题目内容
【题目】某研究性学习小组对中和反应进行探究,请你参与实验。
[探究活动1]证明酸和碱发生了反应。
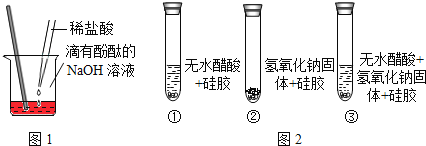
稀盐酸和NaOH溶液混合没有明显现象,小丽同学按图1进行实验,证明了盐酸和NaOH溶液能发生化学反应,他依据的实验现象是__________,反应的化学方程式________。
[探究活动2]能否通过证明有水生成来证明其反应的发生?
[设计实验]小明同学取变色硅胶、无水醋酸和氢氧化钠固体进行如图2所示的三个实验,
[小资料]a变色硅胶吸水后由蓝色变为红色: b无水醋酸是一种酸,常温下为无色液体;
(1)实验①、②的实验目的是________。
(2)加入试剂后,要迅速塞紧橡胶塞的原因是_________。
(3)能证明酸和碱反应有水生成的现象是__________。
[探究活动3]能否通过测量酸和碱反应过程的pH、温度变化证明其反应的发生?取一定量的稀盐酸,连滴匀速滴加NaOH溶液,用电子传感器实时获得溶液的pH、温度曲线如图3.
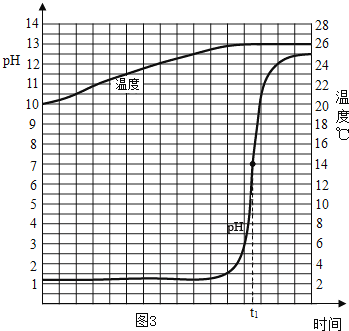
(4)由图3你得到的认识请写出两条:__________、_________。
(5)除了上述方法之外,还可以按照如下实验方法证明稀盐酸与氢氧化钠发生了反应,说出对应的实验现象和实验结论。
实验步骤 | 实验现象 | 实验结论 |
取少量氢氧化钠溶液于试管中,加入过量稀盐酸,再加入少量氧化铜。 | ______;_______ | _______;_______ |
【答案】溶液由红色变成无色 ![]() 证明了无水醋酸和氢氧化钠不含水,不能使变色硅胶变色 防止空气中的水分进入试管干扰试验 试管③中的变色硅胶由蓝色变为红色,试管①②中的变色硅胶不变色 稀盐酸中滴加氢氧化钠溶液,溶液的pH增大 中和反应放热 生成蓝色沉淀 溶液为蓝色 酸、碱没有发生反应 酸、碱发生了反应
证明了无水醋酸和氢氧化钠不含水,不能使变色硅胶变色 防止空气中的水分进入试管干扰试验 试管③中的变色硅胶由蓝色变为红色,试管①②中的变色硅胶不变色 稀盐酸中滴加氢氧化钠溶液,溶液的pH增大 中和反应放热 生成蓝色沉淀 溶液为蓝色 酸、碱没有发生反应 酸、碱发生了反应
【解析】
探究活动1:证明酸和碱发生了反应
稀盐酸和NaOH溶液混合没有明显现象,氢氧化钠溶液呈碱性,滴加酚酞试剂呈红色,氢氧化钠与稀盐酸反应生成氯化钠和水,稀盐酸呈酸性,氯化钠呈中性,均不能使酚酞试剂变色,小丽同学按图1进行实验,将稀盐酸滴入滴有酚酞的氢氧化钠溶液中,可以证明盐酸和NaOH溶液能发生化学反应,依据的实验现象是溶液由红色变为无色,反应的化学方程式为![]() 。
。
探究活动2:通过证明有水生成来证明反应的发生
根据题干信息和图2所示的三个实验装置图可知:
(1)实验①、②的实验目的是证明无水醋酸和氢氧化钠不含有水,不能使变色硅胶变色。
(2)空气中含有水蒸气,进入试管后被吸收会干扰实验,加入试剂后,要迅速塞紧橡胶塞的原因是防止空气中的水分进入试管干扰试验。
(3)能证明酸和碱反应有水生成的现象是试管③中的变色硅胶由蓝色变为红色,试管①②中的变色硅胶不变色。
探究活动3:通过测量酸和碱反应过程的pH、温度变化证明其反应的发生
根据实验过程和得出的相关数据可知:
(4)由图3可知稀盐酸中滴加氢氧化钠溶液,溶液的pH值增大;溶液的温度升高,酸和碱的中和反应放热。
(5)由题意所给的实验方法的原理为,氢氧化钠与氧化铜不反应,稀盐酸与氧化铜反应生成氯化铜和水,若氢氧化钠与稀盐酸不反应,氯化铜与氢氧化钠在溶液中反应生成氢氧化铜沉淀和氯化钠;若氢氧化钠与稀盐酸反应,稀盐酸过量,不会出现氯化铜与氢氧化钠在溶液中反应的现象,溶液为蓝色;则有:
若实验现象为生成蓝色沉淀,则实验结论为酸、碱没有发生反应;
若实验现象为最终溶液呈蓝色,则实验结论为酸、碱发生了反应。

【题目】某学校科学兴趣小组设计一个实验,来模拟研究CO2浓度增加是否导致地球温室效应增强。他们的实验和操作步骤如下:
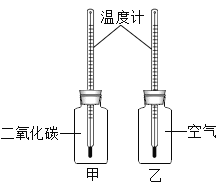
Ⅰ.在两只相同的玻璃瓶里分别充满CO2和空气,并编号为甲、乙,塞紧带有同样温度计的橡皮塞。再把两只玻璃瓶放在阳光下照射(如上图所示),观察甲、乙瓶中的温度变化。
Ⅱ.阳光持续照射,间隔一定时间测量两只玻璃瓶温度值,并记录在下表中:
时间 | 9︰23 | 9︰28 | 9︰33 | 9︰38 | 9︰43 | 9︰48 | 9︰53 | 9︰58 | 10︰06 | 10︰11 | 10︰25 |
甲瓶温度/C | 13.0 | 19.8 | 23.5 | 26.0 | 26.4 | 27.0 | 27.5 | 27.8 | 28.0 | 28.0 | 28.1 |
乙瓶温度/ C | 13.0 | 19.0 | 22.8 | 25.0 | 26.0 | 26.5 | 27.0 | 27.4 | 27.9 | 28.0 | 28.1 |
请完成下列空白:
(1)往瓶中充CO2时,验证瓶中已充满了CO2的方法是_________________________________。
(2)该实验中,照射同样时间,根据上表的数据,比较甲、乙瓶温度变化的规律是__________。
(3)有同学认为根据该模拟实验的目的,实验设计存在问题,你认为有什么问题?(写出一点即可) _________________________________。