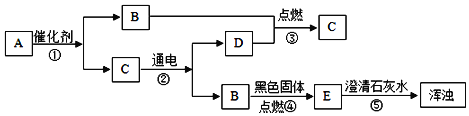
题目内容
【题目】小科为了探究金属与盐溶液的反应规律,按如图所示进行实验。结合实验现象,以下结论错误的是
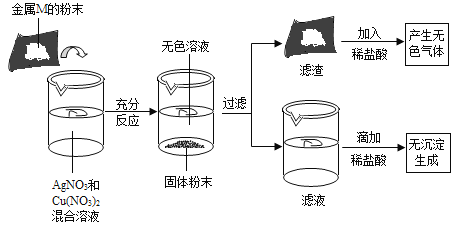
A. 滤液中一定没有银离子B. 滤渣中一定含有单质铜
C. 滤渣中一定含有金属单质MD. 加入的金属M可能是单质铁
【答案】D
【解析】
混合溶液变成无色,说明加入的M能与硝酸铜反应,M的金属活动性比银、铜强,在硝酸铜和硝酸银的混合溶液中加入一定质量的M粉,M先与硝酸银溶液反应生成M盐溶液和银,硝酸银反应完,若还有M粉,M才能与硝酸铜溶液反应生成M盐溶液和铜。根据充分反应后得到无色溶液,说明硝酸铜和硝酸银已经完全反应;向滤渣中加入稀盐酸,产生无色气体,说明滤渣中含有金属M,即金属M是过量的;向滤液中滴加稀盐酸时,无沉淀生成,说明滤液中不含有硝酸银。
A、向滤液中滴加稀盐酸时,无沉淀生成,说明滤液中不含有硝酸银,即滤液中一定没有银离子,故A正确。
B、根据充分反应后得到无色溶液,说明硝酸铜和硝酸银已经完全反应,则滤渣中一定含有单质铜,故B 正确。
C、向滤渣中加入稀盐酸,产生无色气体,银、铜均不与稀盐酸反应,则滤渣中一定含有金属单质M,故C正确。
D、加入的金属 M 不可能是单质铁,因为铁与硝酸银、硝酸铜溶液反应生成硝酸亚铁溶液,硝酸亚铁溶液显浅绿色,而实验中得到的溶液是无色的,故D 错误。故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】不同温度下,碳酸钠和碳酸氢钠的溶解度如下表所示
温度/℃ 溶解度/g | 0 | 20 | 40 | 60 |
碳酸钠 | 7.0 | 21.8 | 48.8 | 46.4 |
碳酸氢钠 | 6.9 | 9.6 | 12.7 | 16.4 |
⑴ 服用碳酸氢钠治疗胃酸过多时,胃液的pH________(填“增大”、“减小”或“不变”),发生反应的化学方程式是____________________。
⑵为区分碳酸钠和碳酸氢钠两种白色固体。在20℃时,各盛有100mL水的甲、乙两烧杯中,分别加入等质量的碳酸钠和碳酸氢钠固体,充分溶解后,现象如图所示。

甲烧杯中加入的物质是________(填化学式),加入的质量m的范围为:______________。