题目内容
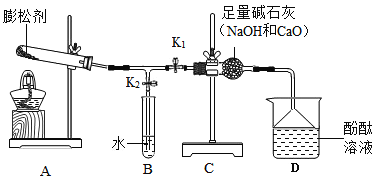
【题目】有关水的实验装置如下图所示。
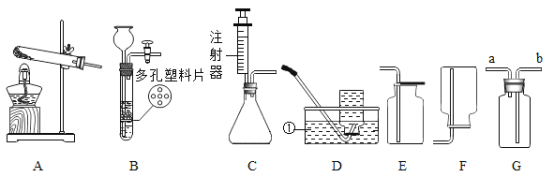
(1)图1为简易净水装置,其中小卵石、石英沙的作用是_______,活性炭的作用是______;图2为蒸馏装置,海水分别经图1与图2装置单独处理后,所得水质成分的区别是______________________。
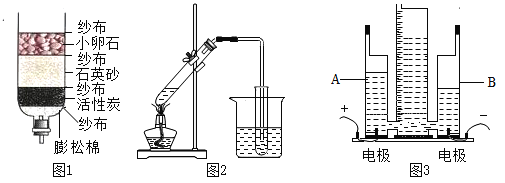
(2)图3为简易水电解器,其中A管中产生的气体是_______。写出电解水的文字或符号表达式:____________。
(3)区别硬水和软水用_________;井水中往往含较多的可溶性钙、镁化合物,用硬水洗衣服,加入肥皂后,产生的泡沫少,还会形成白色垢状物,使衣物变硬。日常生活中使用硬水会带来许多麻烦,家庭中通常采用____________的方法降低水的硬度。
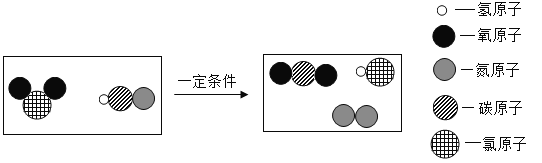
(4)探究水电解的微观过程,小东同学做了一些分子、原子的模型,其中能保持水的化学性质的粒子模型的是______(填标号)。
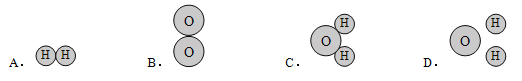
(5)为了保持江河湖海的秀丽,某同学向市政府提出了保护的几条建议:
①向江河中放养适量的鱼虾,保持生态平衡;
②清理江河中的污泥;
③禁止向河道内倾倒垃圾;
④禁止使用化肥和农药,防止水质污染。
其中你认为不合理的是(填序号):______。
【答案】过滤 吸附 图1所得的水中含有氯化钠等可溶性杂质,图2所得的水(蒸馏水)是纯水 氧气 ![]() 肥皂水 煮沸 C ④
肥皂水 煮沸 C ④
【解析】
(1)图1为简易净水装置,其中小卵石、石英沙的颗粒之间有缝隙,水是液体能从缝隙中通过,而固体杂质因为颗粒体积相对较大,不能通过,所以简易净水装置中小卵石、石英沙的作用是:过滤;因为活性炭具有疏松多孔的结构,具有吸附能力,所以简易净水装置中活性炭的作用主要是:吸附;海水经过图1简易净水装置,只能除去难溶于水的固体杂质和异味、色素,海水中的氯化钠等可溶性的盐不能除去,因此图1装置得到的水中含有氯化钠等可溶性杂质;图2为蒸馏装置,海水经图2装置单独处理后,所得水为蒸馏水,是纯水。故海水分别经图1与图2装置单独处理后,所得水质成分的区别是:图1所得的水中含有氯化钠等可溶性杂质,图2所得的水(蒸馏水)是纯水。
(2)图3为简易水电解器,水电解器中正极得到的氧气,负极得到的氢气。A管与正极相连,因此A管中产生的气体是:氧气。水在通电条件下分解生成氢气和氧气,故电解水的文字或符号表达式为:![]() 。
。
(3)硬水中含有较多可溶性钙镁化合物,肥皂水加入其中会形成较多浮渣。等量的水样中分别加入等量的肥皂水振荡或搅拌,如果出现浮渣多,泡沫少的现象,该样品为硬水,如果出现泡沫多,浮渣少的现象,该样品为软水。因此区别硬水和软水可用肥皂水;因为硬水中含有的可溶性钙镁化合物在加热条件下易分解生成难溶于水的碳酸钙、氢氧化镁等物质,所以加热煮沸过程中可溶性钙镁化合物会大大减少,降低水的硬度。因此家庭中通常采用煮沸的方法降低水的硬度。
(4)根据图示,A表示的是H2,B表示的是O2,C表示的是H2O,D表示的是水分子分解成的氢原子和氧原子。对于由分子构成的物质来说,分子是保持物质化学性质的最小粒子,因此保持水的化学性质的最小粒子是水分子,而一个水分子是由两个氢原子和一个氧原子构成的。故能保持水的化学性质的粒子模型的是C。
(5)①向江河中放养适量的鱼虾,保持生态平衡,正确;
②清理江河中的污泥,减少水中的污染物,正确;
③禁止向河道内倾倒垃圾,可以防止水体污染,正确;
④禁止使用化肥和农药,不正确,应该合理使用化肥和农药。因此建议中不合理的是:④。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】装置的气密性的检查方法有很多,如可用推拉注射器活塞的方法。当缓慢推活塞时,如果装置气密性良好,可观察到的现象是

A.长颈漏斗下端口产生气泡
B.瓶中液面上升
C.注射器内有液体
D.长颈漏斗内液面上升
【题目】氢化钙固体是登山运动员常用的能源提供剂。某探究小组的同学通过查阅资料得知:氢化钙![]() 遇水反应生成氢氧化钙和氢气。探究斯小组的同学把一定量的
遇水反应生成氢氧化钙和氢气。探究斯小组的同学把一定量的![]() 加入
加入![]() 溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
(提出问题)滤液中溶质的成分是什么?
猜想一:NaOH猜想二:NaOH、![]()
猜想三:NaOH、![]() 猜想四:NaOH、
猜想四:NaOH、![]() 、
、![]()
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因______。
(实验验证)
实验 | 现象 | 结论 |
| 无明显现象 | 猜想 ______ 不成立 |
| ______ | 猜想三成立 |
(反思与拓展)
![]() 写出氢化钙
写出氢化钙![]() 与水反应的化学方程式______。
与水反应的化学方程式______。
![]() 若向
若向![]() 的溶液中加入一定量的
的溶液中加入一定量的![]() ,充分反应,产生的气体有氢气和______。
,充分反应,产生的气体有氢气和______。
![]() 登山运动员携带
登山运动员携带![]() 作为能源提供剂与携带氢气相比,其优点是______
作为能源提供剂与携带氢气相比,其优点是______![]() 写一条即可
写一条即可![]() 。
。
【题目】元素周期表是学习和研究化学的重要工具。下图是元素周期表的一部分。
IA | O | |||||||
1 | 1 H 1.008 | ⅡA | ⅢA | ⅣA | V A | ⅥA | ⅦA | 2 He 4.003 |
2 | 3 Li 6.941 | 4 Be 9.012 | 5 B 10.8l | 6 C 12.01 | 7 N 14.0l | 8 0 16.00 | 9 F 19.00 | 10 He 20.8l |
3 | 11 Na 22.99 | 12 Mg 24.31 | 13 Al 26.98 | 14 Si 28.09 | 15 P 30.97 | 16 S 32.06 | 17 Cl 35.45 | 18 Ar 39.95 |
(1)很多科学家对元素周期表的发现和完善做出了重大贡献,请写出其中一位科学家的名字:_____。
(2)碳的相对原子质量是_____。
(3)硫元素的原子结构示意图为_____。它属于_____元素(填“金属”或“非金属”),其化学性质比较活泼,在化学反应中易_____(填“得”或“失”)电子。
(4)表中不同种元素最本质的区别是_____(填符号)。
A 质子数不同
B 中子数不同
C 相对原子质量不同
D 电子数不同
(5)利用元素周期表,人们对元素的认识进入全新的飞跃时期。近年,俄罗斯科学家曾宣布他们将人工合成第118号元素,则此元素原子核内的质子数为_____。