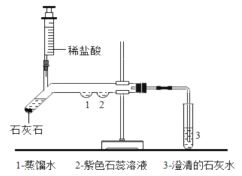
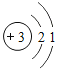题目内容
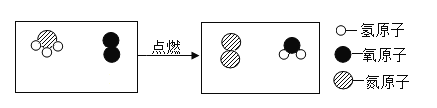
【题目】同学们在老师指导下进行氢气还原CuO实验,有关的反应是H2+CuO![]() Cu+H2O。
Cu+H2O。
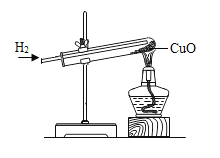
(实验步骤)
(1)先制取氢气(有关的化学方程式是___),再按下图所示装置连好仪器、装好药品。
(2)先通入一会儿氢气(目的是____),然后加热CuO。
(3)待CuO全部变红,停止加热,继续____至试管冷却。
(发现问题)反应生成的红色固体全部是铜吗?
(查阅资料)
①氢气还原CuO时,若反应不彻底,红色固体还可能是Cu2O。
②Cu2O与稀硫酸发生如下反应:Cu2O+H2SO4=CuSO4+Cu+H2O
(作出猜想)
红色固体的成分:①只有Cu;②只有Cu2O;③____。
(实验验证)
(1)取少量红色固体装入试管,加入足量的稀硫酸,溶液变成蓝色,且仍有红色固体残留。据此可知,猜想____不成立。
(2)再取3.6g红色固体加入足量稀硫酸中,充分反应后过滤,将红色滤渣洗涤、干燥后,称其质量为2.1g,则猜想____成立。
(实验改进)考虑上述实验的不足,同学们对其进行改进。
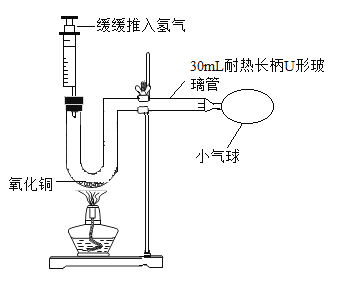
(1)针对如图的改进装置,下列叙述正确的是____。
A 推入30mL氢气时,装置内空气基本排尽
B 实验过程中,长柄U形玻璃管内壁看不到水珠
C 实验结束,取下小气球点燃,能听到爆鸣声
(2)与原装置相比,改进装置的优点是____(写1条)。
【答案】Zn + H2SO4= ZnSO4 + H2↑ 将装置内的空气瓶排除尽,防止发生危险 通入氢气 同时有Cu和Cu2O ① ③ AC 安全可靠或节约氢气
【解析】
(1)实验室用锌粒和稀硫酸制取氢气的化学方程式是:Zn + H2SO4== ZnSO4+ H2↑再按下图所示装置连好仪器、装好药品。
(2)先通入一会儿氢气目的是:将装置内的空气瓶排除尽,防止发生危险,然后加热CuO。
(3)待CuO全部变红,停止加热,继续通入氢气,防止铜钡氧化,至试管冷却。
红色固体的成分:①只有Cu;②只有Cu2O;③同时有Cu和Cu2O
(1)取少量红色固体装入试管,加入足量的稀硫酸,溶液变成蓝色,且仍有红色固体残留。据此可知,猜想①不成立,铜和稀硫酸不能反应生成硫酸铜蓝色溶液;
(2)解:设3.6g都为氧化亚铜固体,生成铜的质量为x。
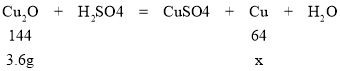
![]()
x=1.6g,剩余固体质量为2.1g,两者不相等;则说明原固体中含有铜和氧化亚铜的混合物固体;
则猜想③成立;
(1)
A、推入30mL氢气时,装置内空气基本排尽;防止发生危险;故选项正确;
B、实验过程中,长柄U形玻璃管内壁可以看到到水珠,氢气加热条件下还原氧化铜:CuO+H2![]() Cu+H2O;故选项错误;
Cu+H2O;故选项错误;
C、实验结束,取下小气球中混有空气和氢气点燃,能听到爆鸣声;故选项正确;
故选:AC。
(2)与原装置相比,改进装置的优点是:安全可靠或节约氢气。

 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案【题目】学习了二氧化锰对过氧化氢分解有催化作用的知识后,某同学想:氧化铜能否起到类似二氧化锰的催化作用呢?于是进行了以下探究。
(猜想)Ⅰ. 氧化铜不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ、氧化铜参与反应产生氧气,反应前后质量和化学性质发生了改变;
Ⅲ、氧化铜是反应的催化剂,反应前后________________________。
(实验)天平称量0.2g氧化铜,取5mL5%的过氧化氢溶液于试管中,进行如下实验:
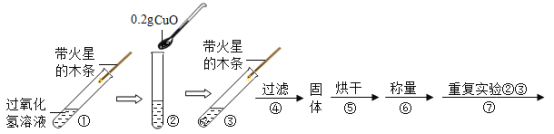
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
溶液中有气泡放出,带火星的木条复燃。 | 称量氧化铜质量为___________________。 | ________________。 | 猜想Ⅰ、Ⅱ不成立: 猜想Ⅲ成立。 |
(2)步骤⑦的目的是验证________________________。
【题目】化学兴趣小组的同学对某膨化食品包装袋内气体的成分进行探究,请你多与他们的探究,并回答下列问题.
[提出问题]包装袋内的气体成分是什么?
[猜想与假设]包装袋内的气体为猜想1:氧气;猜想2:氮气;猜想3:二氧化碳:猜想4:二氧化硫。
(1)通过分析,大家认为猜想1是错误的,理由是氧气化学性质比较活泼.食品易与氧气发生级慢氧化面变质;猜想4也是错误的,理由是________________。
[进行实验]为了探究气体的成分,甲.乙两位同学分别进行了如下实验。
[查阅资料]镁能在氮气中燃烧,反应生成氮化铁(Mg3N2)固体。氮化镁可与水剧烈反应产生氨气.该气体能使湿润的红色石蕊试纸变蓝。
(2)甲同学收集一.瓶该气体,把一根燃着的木条伸人瓶中,发现木条熄灭。由此得出气体是二氧化碳。乙同学认为该方案不可行.理由是_______________。
(3)为了验证剩余猜想,乙同学设计如下图所示方案
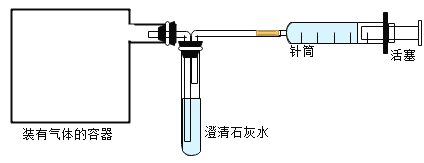
①在装有该气体的容器(容器内压强接近大气压强)上连接一个如图装置。向右拉动注射署活塞,经过实验后,发现澄清石灰水不变浑浊,证明猜想3不成立,猜想2.成立。
②为进一步确认猜想2成立,乙同学又进行了实验:
实验操作 | 实验现象 | 结论 |
a.另取一瓶气体,向其中伸入燃着的镁条,观察现象; b.取少量反应后固体于试管中。加入足量的蒸馏水然后______________________________观察现象 | a.镁条燃烧,发出耀眼白光;b红色的石蕊试纸___________。 | 猜想2成立 |
[交流讨论]
(4)试写出镁与氮气反应的化学方程式:_________________。
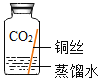
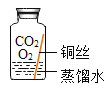
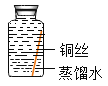
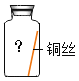
【题目】某些铜制品在空气中久置,表面生成绿色的铜锈(又称铜绿),主要成分是Cu2(OH)2CO3。某化学实验小组设计并进行实验,探究铜生锈的条件。
(提出猜想)根据铜锈的组成推测,铜生锈可能与CO2、H2O和O2有关。
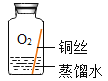
(进行实验)实验小组同学取直径、长度均相同的铜丝,并打磨光亮。设计了如下图所示的5个实验并持续观察。
编号 | ① | ② | ③ | ④ | ⑤ |
实验 |
|
|
|
|
|
现象 | 无明显现象 | 无明显现象 | 铜丝表面有绿色物质 | 无明显现象 | 无明显现象 |
(解释与结论)
(1)实验中使用“经煮沸迅速冷却的蒸馏水”,其目的是_____。
(2)得出“铜生锈一定与CO2有关”的结论,依据的两个实验是_____(填编号)。
(3)对比实验②和③,得出的结论是_____
(4)为验证猜想,请在下图中将实验⑤补充完整。__________
(5)结合上述实验,你对保存铜制品的建议是_____。