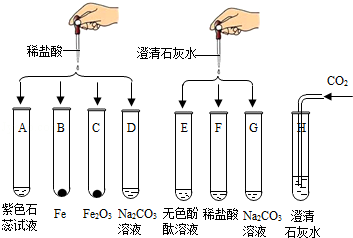
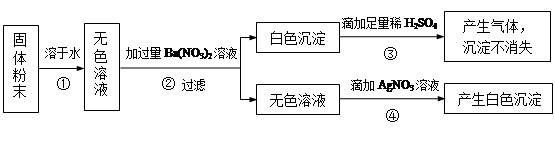题目内容
向100g稀H2SO4溶液中加入一定量的镁粉,固体完全溶解后,再向所得溶液中加入质量分数为20%的NaOH溶液,所得沉淀质量与加入NaOH溶液质量关系如图所示。请回答: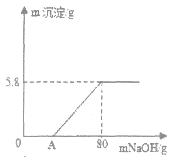
(1)OA段无沉淀产生,请写出反应的化学方程式
(2)加入镁粉的质量为 g;
(3)求产生氢气的质量是多少g?(写出计算过程,保留小数点后一位)。
(1)2NaOH+H2SO4==Na2SO4+2H2O、(2)2.4g (3) 0.2g
解析

(10分)二十一世纪是海洋开发与利用的世纪,某市规划确立了“蓝色经济”发展战略,海洋化学资源的综合利用将是重点发展领域之一。以下是某研究性学习小组在探究海水综合利用中遇到的问题,请你参与探究:
问题一、海水制镁过程中如何富集镁离子?
甲、乙、丙三位同学各自提出自己的设想:
甲:直接往海水中加入石灰乳。
乙:高温加热蒸发海水后,加入石灰乳。
丙:向晒盐后的卤水中,加入石灰乳。
通过分析比较,你认为___________的设想最为经济合理(选填“甲”、“乙”或“丙”)。
问题二、粗盐提纯过程中如何除去可溶性杂质?
【查阅资料】
粗盐中含有硫酸钠、氯化钙等可溶性杂质。
【设计实验】
提纯时,先向粗盐水中加过量的氢氧化钡溶液,目的是_____①________;再加过量的____②______,除尽杂质阳离子;滤去沉淀,向滤液中加入__③_____,将溶液的pH调为7,即得到精盐水。
问题三、海水“制碱” 的产物成分是什么?
同学们从某企业取回少量碳酸氢钠受热完全分解后的固体样品,为确定其成分,进行
了如下探究:
【提出猜想】
甲的猜想:样品中只含有碳酸钠;
乙的猜想:样品中只含有氢氧化钠;
丙的猜想:样品中含有碳酸钠和氢氧化钠。
他们做出上述三种猜想的科学依据是________________________________。
【实验、记录与分析】
| 步骤 | 实验操作 | 实验现象 | 结论 |
| 1 | 取少量样品于试管中,加水完全 溶解,再加入________________ | _____________________ | 乙的猜想 不成立 |
| 2 | 取步骤1反应后的溶液于试管中 ___________________________ | 无明显现象 | 只有甲的 猜想成立 |
海水“制碱”的最终固体产物是碳酸钠。
【数据分析】
在取回的样品中加入200g7.3%的稀盐酸,恰好完全反应,请计算同学们带回了多少克固体样品?(要求有解题过程)
一同学用某种粗盐进行提纯实验,步骤见下图。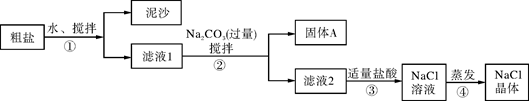
请回答:
(1)步骤①和②的操作名称是 。
(2)步骤③判断加入盐酸“适量”的方法是 ;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止 ,当蒸发皿中有较多量固体出现时,应 ,用余热使水分蒸干。
(3)猜想和验证:
| 猜想 | 验证的方法 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | | 猜想Ⅰ成立 |
| 猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入 ,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | |
| 猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水, | | 猜想Ⅲ成立 |