题目内容
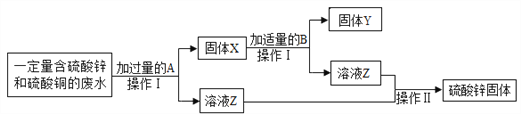
【题目】为了测定硫酸铵和氯化铵混合物中氯化铵的质量分数,甲、乙两位同学按下图所示实验步骤进行实验:

(1)实验时,甲同学使用硝酸银溶液作试剂A,乙同学选用氯化钡溶液作试剂A。其中所选择的试剂A不合理的是________同学。
(2)以下都是指正确使用试剂A时进行的实验:
①为进行称量、溶解、反应、过滤,洗涤沉淀的各项操作,准备了以下仪器:托盘天平与砝码、烧杯、过滤器、铁架台及附件、胶头滴管、量筒。其中还缺少的一件必备仪器是________。
②简述判断沉淀B是否洗净的方法________________________________________________________。
③若实验中测得样品质量为Wg,沉淀质量为mg,则氯化铵的质量分数=________________。
④若过滤所得沉淀未经洗涤即烘干称重,测得结果将________(填“偏高”、“偏低”、“不变”)。
【答案】甲 玻璃棒 取最后的洗涤液,滴加![]() 溶液。若无沉淀生成,则沉淀已洗净;反之未洗净。
溶液。若无沉淀生成,则沉淀已洗净;反之未洗净。 ![]() 偏低
偏低
【解析】
(1)银离子可以和氯离子反应生成氯化银沉淀,也可以和硫酸根离子生成微溶物,会干扰试验,故甲同学不合理。
(2)①溶解和过滤的过程中需要玻璃棒,故缺少玻璃棒。
②如没有清洗干净,则清洗液中含有氯离子,故方法是向最后清洗的液体中加入硝酸银,如不变浑浊,则清洗干净。
③设混合物中硫酸铵的质量为x

![]() 解得x=
解得x=![]() ,
,
故样品中氯化铵的的质量分数为:1-![]() ÷W×100%=
÷W×100%=![]() 。
。
④若过滤所得沉淀未经洗涤即烘干称重,则称得的固体质量偏大,故硫酸铵的质量分数偏大,故氯化铵的质量分数偏小。

练习册系列答案
相关题目