题目内容
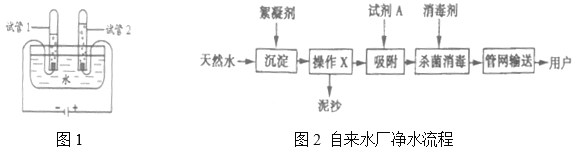
【题目】在一烧杯中盛有由![]() 和
和![]() 组成的固体混合物25g,向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的质量与滴入稀盐酸的质量关系如图所示(已知反应的化学方程式为:
组成的固体混合物25g,向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的质量与滴入稀盐酸的质量关系如图所示(已知反应的化学方程式为:![]() )。请分析曲线图后回答下列问题:
)。请分析曲线图后回答下列问题:
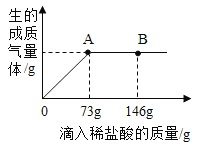
(1)当滴加稀盐酸至图中A点时,烧杯中溶液的![]() (不考虑
(不考虑![]() 的溶解)______7(填“>”或“=”或“<”),溶液中的溶质为_______(填化学式)。当滴加稀盐酸至图中B点时,烧杯中溶液的
的溶解)______7(填“>”或“=”或“<”),溶液中的溶质为_______(填化学式)。当滴加稀盐酸至图中B点时,烧杯中溶液的![]() _______7(填“>”或“=”或“<”)。
_______7(填“>”或“=”或“<”)。
(2)A点时消耗溶质![]() 的质量为_____g,放出
的质量为_____g,放出![]() 的质量________g。
的质量________g。
(3)计算原固体混合物中氯化钠的质量分数________。
【答案】= NaCl < 7.3 4.4 57.6%
【解析】
(1)根据图可以看出,当滴加盐酸至73g时也就是A点时,此时气体达到最大量,也就是恰好完全反应,由于不考虑二氧化碳的溶解,此时溶液pH等于7,溶质只有氯化钠。而继续滴加盐酸时,由于盐酸剩余,所以此时pH小于7,溶质为HCl和NaCl。
(2)在A点时消耗的HCl的质量为73g×10%=7.3g。
设消耗7.3gHCl时反应的碳酸钠的质量为x,生成的二氧化碳的质量为y
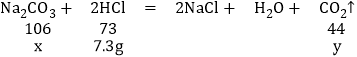
![]()
x═10.6g
y=4.4g
(3)到达B气体二氧化碳的质量也依旧是4.4g。
所以混合物中氯化钠的质量为25g-10.6g═14.4g
混合物中 氯化钠的质量分数为![]()

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目