题目内容
【题目】氢气是一种理想的新能源,具有广阔的开发前景。铁酸锌(ZnFe2O4)可用于循环分解水制氢气,其反应可表示为:
![]() ;
;![]()
(1) ZnFe2O4中Fe的化合价为___________。
(2)该循环制氢中不断消耗的物质是___________。
(3)氢气作为新能源,有不污染环境、热值大、原料来源丰富等优点,但目前并没有被广泛应用,你认为主要原因是_______。
【答案】+3 H2O 制备氢气能耗大,成本高等
【解析】
(1)ZnFe2O4中锌的化合价为+2价,氧元素的化合价为-2,设Fe的化合价为x,则有(+2)+2x+(-2)×4=0,x=+3,故填:+3。
(2)该循环制氢中不断消耗的物质是水。
(3)现在最理想的制取氢气的方法是通过太阳能和催化剂使水分解,所以现在主要困难是制备氢气能耗大,成本高等,这都是导致氢气没有得到广泛应用的原因。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
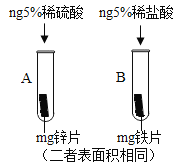
黄冈小状元口算速算练习册系列答案【题目】2018年5月18日我国第一艘国产航母试海成功,航母的许多电字元件使用了黄铜。为测定某黄铜(假设合金中仅含铜,锌)中铜的质量分数,兴趣小组同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应,测得实验数据如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀硫酸的质量(g) | 20 | 20 | 20 | 20 |
烧杯中剩余物的质量(g) | 39.92 | 59.84 | 79.80 | 99.80 |
(1)黄铜粉末完全反应生成氢气的总质量为____________g。
(2)该黄铜中铜的质量分数为多少?(写出计算过程)____________
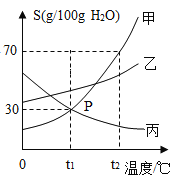
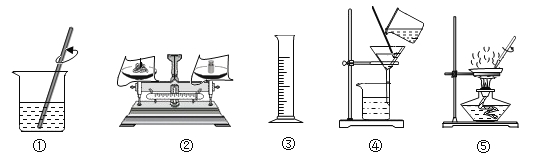
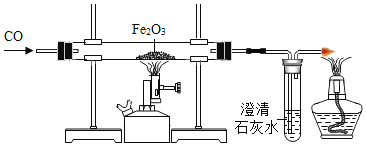
【题目】金属在人类生活和生产中应用十分广泛,下列是关于金属的三组实验,请回答下列问题。
实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
|
|
|
(1)实验Ⅰ中以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为该实验设计不够合理,理由是___________________。
(2)写出实验Ⅱ中C试管内反应的化学方程式__________________。
(3)实验Ⅲ为实验室模拟炼铁的装置图。
①加热Fe2O3之前要先通一会 CO,目的是__________________。
②装置末加酒精灯装置的目的是__________________。
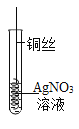
【题目】某小组同学在实验室研究铝与氯化铜溶液的反应。
实验操作 | 实验现象 |
| ①红色物质附着于铝片表面 ②铝片表面逸出大量无色气体,放出大量的热 ③烧杯底部出现红色沉淀和白色沉淀 |
(1)打磨铝片的目的是__________。
(2)现象①和现象③中的红色物质均为Cu,生成该物质的化学方程式为______________。
(3)经检验,现象②中的无色气体为氢气。甲同学猜测可能是氯化铜溶液显酸性,经pH计检验,pH_____7,证实了甲的猜想。
(4)探究白色沉淀的化学成分。
乙同学通过查阅资料认为白色沉淀可能是氯化亚铜(CuCl)。
CuCl中铜元素的化合价是________。
【查阅资料】
①CuCl可与浓氨水反应生成无色的Cu(NH3)2+和Cl-。
②Cu(NH3)2+在空气中易被氧化变为蓝色;Cl-可与硝酸银溶液反应,产生白色沉淀。
【进行实验】
①取烧杯底部的白色沉淀,充分洗涤;
②向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
③取其中一份无色溶液……
④将另一份无色溶液放置于空气中……
以上步骤③的实验方案是________;步骤④的现象是________。
【得出结论】通过实验可以确定,该白色固体是CuCl。
【反思与评价】Al和CuCl2溶液反应为什么会出现CuCl呢?
丙同学猜测:可能是Cu与CuCl2溶液反应生成了CuCl。
丙同学为了验证猜想,取Cu粉与15% CuCl2溶液混合,无白色沉淀产生。
(5)丙通过分析Al与CuCl2溶液反应的实验现象,改进了实验,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是________。
(6)丁同学认为丙同学的实验还不够严谨,还应考虑________对Cu与CuCl2溶液反应的影响。