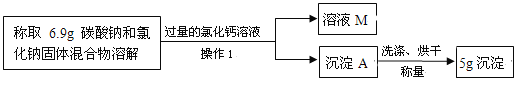
��Ŀ����
����Ŀ���������ƾ���zCaO2��8H2O�{���ȶ����ʰ�ɫ������ˮ���㷺Ӧ���ڻ���ɱ�����������Ա���Ϊԭ���Ʊ�CaO2�������£�
��1������X�� �����������ƾ�������Һ����ķ����� ��
��2����ӦY������¶���0~5�棬�ɽ���Ӧ�������ڱ�ˮ������У���Ӧ������CaO2��8H2O������д����ѧ����ʽ �÷�Ӧ�Ļ�����Ӧ������ ����õĹ������ƾ����г�����Ca(OH)2���ʣ�ԭ���� ��
���𰸡���1��CO2 , ���� ��2��CaO �� H2O2 �� 7H2O �� CaO2��8H2O , ���Ϸ�Ӧ ��CaO������
��������
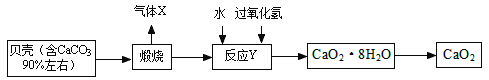
�����������1��������Ҫ�ɷ���̼��ƣ��������շ����ֽⷴӦCaCO3 ![]() CO2��+ H2O����X�Ƕ�����̼��ͨ�����˿ɽ�������Һ����� ��2����������ʾ��ͼ��Ӧ�Ļ�ѧ����ʽ�ǣ�CaO �� H2O2 �� 7H2O �� CaO2��8H2O���÷�Ӧ��3�����ʷ�����Ӧ����һ�����ʣ����ϡ����һ�������ڻ��Ϸ�Ӧ���������ƹ���ʱ������ˮ��Ӧ��������������ʹ��õĹ������ƾ����г�����Ca(OH)2���ʡ�
CO2��+ H2O����X�Ƕ�����̼��ͨ�����˿ɽ�������Һ����� ��2����������ʾ��ͼ��Ӧ�Ļ�ѧ����ʽ�ǣ�CaO �� H2O2 �� 7H2O �� CaO2��8H2O���÷�Ӧ��3�����ʷ�����Ӧ����һ�����ʣ����ϡ����һ�������ڻ��Ϸ�Ӧ���������ƹ���ʱ������ˮ��Ӧ��������������ʹ��õĹ������ƾ����г�����Ca(OH)2���ʡ�

����Ŀ��ʵ���ҿ����գ���ѧС���ͬѧ����ʵ���ң���������ʺܸ���Ȥ������ʦ����о���������ʣ���ʦ���˴�Ӧ������ͬѧ�ǽ������������ʵ�ʵ��̽����
��ʵ����ơ�
��1����ʯ����Һ����ϡ�����У�Ԥ��ʯ����Һ����ɫ�� ɫ��
��2����ZnƬͶ��ϡ�����У�Ԥ�ƽ�����������
��ʵ����֤��
ͬѧ�ǰ������������ʵ�飬ȴ����ʯ���ɫ��һ�������ȥ��ZnƬͶ��ϡHNO4����Һ��ð�����ݣ�������ɫ����A�����Թܿ�����A��ɺ���ɫ�д̼�����ζ������B��
��������⡿
��1��ʯ����Һ��ɫ��Ϊ�λ���ɫ��
��2��������������ɫ������ʲô�����������Щ���ԣ�
���������ϡ�
��������쳣����������ʦ��ָ���£�ͬѧ�������鵽���������ϣ�
��1���������Zn��Cu�ȶ��ֽ�����Ӧ������Ӧ�������Σ���������H2��
��2������Ԫ�ص�ijЩ��̬���ʵ�����������
NH3 | N2 | NO | NO2 | |
��ɫ | ��ɫ | ��ɫ | ��ɫ | ����ɫ |
�ܽ��� | ��������ˮ | ������ˮ | ������ˮ | ������ˮ������ |
�������������
��1��С��ͬѧ��Ϊʯ���ɫ������ɫ��ԭ���������Թܲ��ɾ�����������������ɵģ�Ҫ֤��С���Ĺ۵㣬Ӧ���еIJ����� ��
��2�����һ����ͬ�˺���ɫ����B��NO2����������ɫ����A���仯��ԭ���в�ͬ�Ŀ�����
��С��ͬѧ��ΪA��NH3������˴�ҵ�һ�·��ԣ�ԭ���� ��
��Сǿͬѧ��ΪA��N2��Ҳ���ҵ�һ�·��ԣ�ԭ���� ��
�������ۣ����մ�һ����A��NO��NO���Թܿ�����������NO2�Ĺ�ʶ��
��ʵ��̽����
С��ͬѧ��������Cu��Ӧ�ܸ���Ȥ����ȡ��һС��CuƬͶ��ϡHNO3�У�����CuƬ�ܽ⣬Ҳ����������Zn��ϡHNO3��Ӧ����������ȷ��������NO��������ʦ�İ����£����ǡ�÷�Ӧ��Cu��HNO3��������Ϊ8��21���ɴ˻����Cu��ϡHNO3�ķ�Ӧ��ѧ����ʽ ��
�������뷴˼��
����̽��������������ϡHCl��Cu����Ӧ��ϡHNO3ȴ�ܸ�Cu��Ӧ��ԭ��
��
����Ŀ�����ж�һЩ��ʵ�Ľ��Ͳ���ȷ����
��ʵ | ���� | |
A�� | �������� | ���Ӳ��ϵ��˶� |
B�� | H2O2��ɱ��������H2O���� | �������ʵķ��ӹ��ɲ�ͬ |
C�� | �¶ȼ��е�ˮ���������������� | ԭ�ӵĴ�С�����ı� |
D�� | �����ǻ���� | �����к���ͬ�ַ��� |