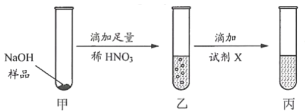
题目内容
【题目】某课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分是氧化铁)炼铁的主要反应原理.它们设计的实验装置如图:
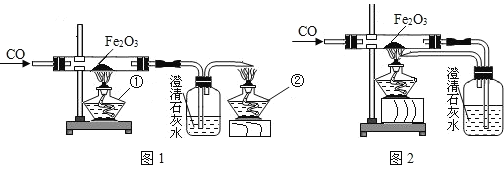
回答下列问题:
(1)写出用一氧化碳还原氧化铁的化学方程式_____.
(2)实验时在澄清石灰水中观察到的现象是______,硬质玻璃管中的现象_______________。
(3)图1中,设计第②个酒精灯的目的是______,其反应的化学方程式为________________,实验时,应先点燃第______个酒精灯.
(4)图2与图1相比,它的主要优点是______________________.
【答案】3CO+Fe2O3![]() 2Fe+3CO2 澄清石灰水变浑浊 红色粉末逐渐变黑 防止未反应的一氧化碳释放到空气中污染空气 2CO+O2
2Fe+3CO2 澄清石灰水变浑浊 红色粉末逐渐变黑 防止未反应的一氧化碳释放到空气中污染空气 2CO+O2![]() 2CO2 ② 节约燃料,减少空气污染.
2CO2 ② 节约燃料,减少空气污染.
【解析】
(1)一氧化碳与氧化铁在高温的条件下反应生成铁和二氧化碳,故反应的化学方程式写为:3CO+Fe2O3![]() 2Fe+3CO2。
2Fe+3CO2。
(2)实验时,生成的二氧化碳与澄清石灰水中的氢氧化钙反应生成碳酸钙沉淀和水,观察到的现象是澄清石灰水变浑浊,故填澄清石灰水变浑浊;
反应中,氧化铁被还原为铁,观察到的现象是红色粉末逐渐变黑,故填红色粉末逐渐变黑。
(3)图1中,使用第②个酒精灯可以燃烧掉尾气中的一氧化碳,防止未反应的一氧化碳释放到空气中污染空气,故填防止未反应的一氧化碳释放到空气中污染空气;
第②个酒精灯处发生的反应是一氧化碳与氧气在点燃的条件下反应生成二氧化碳,故反应的化学方程式写为:2CO+O2![]() 2CO2;
2CO2;
实验时,应先点燃第②个酒精灯,可以燃烧排尽管内空气所用的一氧化碳,防止一氧化碳释放到空气中污染空气,故填②。
(3)尾气中的一氧化碳在玻璃管下方燃烧处理,能够节约燃料,减少空气污染,故填节约燃料,减少空气污染。

【题目】据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。同学们对废旧手机中的金属回收产生兴趣。
(提出问题)
从废旧手机中可以回收到哪些有价值的金属?如何回收?

(查阅资料)
Ⅰ.手机电路板中的金属及其价格如下表所示:
种类 | Fe | Cu | Al | Ni | Au | Ag | Pd(钯) |
市场价格/($/t) | 365 | 7175.5 | 1710.5 | 14235 | 4.7×107 | 7.6×105 | 2.7×107 |
矿石中含量 | 72.4 | 0.87 | 29.1 | 1.02 | 4 | 120 | 0.4 |
手机电路板中含量 | 5 | 13 | 1 | 0.1 | 350 | 1380 | 210 |
说明:Fe、Cu、Al、Ni的含量用质量分数(%)表示,Au、Ag、Pd的含量的单位为“g/t”。
Ⅱ.Ni的金属活动性位于氢前;Pd的金属活动性位于氢后;NiCl2溶液为绿色。
(实验方案)

第一步:选择值得回收的金属。
依据资料Ⅰ中的数据,废旧手机中有回收价值的金属有Au、Ag、Cu、Pd,
(1)原因是:①它们的市场价格较高;②_____。
第二步:设计实验分离、回收部分金属。
序号 | 实验步骤 | 实验现象 |
Ⅰ | 取一废旧手机电路板,用电吹风机靠近电路焊接点的焊锡吹热风,一段时间后,用镊子将金属电路从塑料板中拽出 | 焊锡熔化 |
Ⅱ | 将金属电路放入烧杯中,加入过量10%的稀盐酸浸泡 | …… |
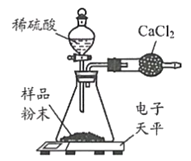
Ⅲ | 取Ⅱ中未溶解的金属电路,用蒸馏水洗净后,放入如上图所示装置中,进行实验。 | 溶液逐渐变成蓝色,仍有微量金属固体未溶解 |
Ⅳ | 过滤Ⅲ中烧杯中的物质,洗涤滤纸上的物质 | 滤纸上仍有微量金属固体 |
(问题讨论)
(2)由步骤I中的现象,可推知的焊锡的物理性质是_____(填字母)。
a.熔点低 b.硬度大 c.抗腐蚀性强
(3)步骤Ⅱ中实验室用溶质质量分数为37%、密度是1.18gmL-1的浓盐酸配制10%的盐酸185g,需要浓盐酸_____ml;配制该稀盐酸应选择的量筒量程(水的密度为1g/cm3)为_____(填字母)。
a.10ml b.50ml c.100ml d.200ml
(4)步骤Ⅱ所得溶液中,至少含有_____(填数字)种溶质,该步骤中对应的实验现象是_____。
(5)请写出步骤Ⅲ中,溶液变成蓝色的化学方程式_____。
(6)步骤Ⅳ中过滤操作用到的玻璃仪器有玻璃棒、_____和_____,其中玻璃棒的作用是_____。